
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。
为了进一步研究硫酸铜的用量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。(假设混合溶液总体积等于混合前各溶液的体积之和)
实验 混合溶液 | A | B | C | D | E | F |
4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
请回答下列问题:
①请完成此实验设计,其中:V3=___,V8=___;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___。
③实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率υ(H2SO4)=___(忽略反应前后溶液体积变化)。
【答案】30 19.5 当加入一定量的CuSO4后,生成的Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积,使得生成氢气的速率下降 0.01mol/(L·min)
【解析】
①要研究硫酸铜的用量对氢气生成速率的影响,要保证其它条件相同,只改变硫酸铜的量,每组硫酸的量要保持相同,六组反应的总体积也应该相同,A组中硫酸为30mL,那么其它组硫酸量也都为30mL,而硫酸铜溶液和水的总量应相同,F组中硫酸铜20mL,水为0,那么总量为20mL,则V8=20mL-0.5mL=19.5mL,V3=30mL,
故答案为:30;19.5;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,降低了锌与溶液的接触面积,会阻碍锌片与硫酸继续反应,氢气生成速率下降,故答案为:当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积;
③收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,
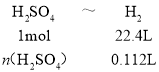
解得:n(H2SO4)=0.005mol,υ(H2SO4)=![]() =
=![]() =0.01mol/(L·min),
=0.01mol/(L·min),
故答案为:0.01mol/(L·min)


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】为研究反应![]() (aq)+2I(aq)
(aq)+2I(aq)![]() 2
2![]() (aq)+I2(aq)的反应机理及反应进程中的能量变化,在
(aq)+I2(aq)的反应机理及反应进程中的能量变化,在![]() 和I的混合溶液中加入Fe3+,过程及图像如下:
和I的混合溶液中加入Fe3+,过程及图像如下:
步骤①:2Fe3+(aq)+2I(aq)![]() I2(aq)+2Fe2+(aq)
I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+![]() (aq)
(aq)![]() 2Fe3+(aq)+2
2Fe3+(aq)+2![]() (aq)
(aq)
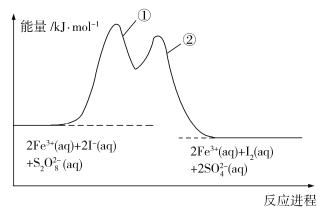
下列有关该反应的说法正确的是______
A.步骤①和②都是吸热反应
B.Fe3+是该反应的中间产物
C.步骤①比②所需活化能大
D.该反应可设计成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温“可呼吸” Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是

A.“吸入”CO2时,钠箔为正极
B.“呼出”CO2时,Na+向多壁碳纳米管电极移动
C.“吸入” CO2时的正极反应式为:4Na++3CO2+4e-=2Na2CO3+C
D.标准状况下,每“呼出”22.4 L CO2,转移电子的物质的量为0.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)元素Y在周期表中的位置是___,丙分子的电子式为____。
(2)若甲与Y单质在常温下混合就有明显红棕色气体的现象,则甲的化学式为___。丙在一定条件下转化为甲和乙的反应方程式为___。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为___(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
写出戊与烧碱的浓溶液加热时反应的离子方程式___。
(4)在标准状况下,用装满丙气体的烧瓶做喷泉实验,喷泉结束后水充满烧瓶,假设烧瓶中溶质不能扩散出来,则所得溶液的物质的量浓度为____。(保留两位有效数字)
(5)X与Y两种元素之间可形成一种18e-微粒的分子,此分子是医疗上常用的消毒剂,请写出此分子的结构式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大___min(填0~1、1~2、2~3、3~4、4~5),原因是____。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是(________)
A.蒸馏水
B.KCl溶液
C.KNO3溶液
D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
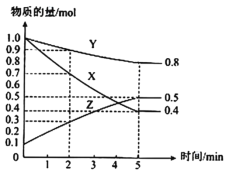
①该反应的化学方程式是___。
②该反应达到平衡状态的标志是___。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成1molY的同时生成2molZ
③2min内X的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是( )

A.电池工作的过程中,溶液中SO![]() 浓度基本不变
浓度基本不变
B.电池工作时,溶液中SO![]() 向c移动
向c移动
C.c为负极,发生氧化反应
D.电池工作的过程中,c电极上产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭常用的高能燃料,常温下为液体,其球棍模型如下图,肼与双氧水反应:N2H4+2H2O2 = N2↑+4H2O 。下列说法正确的是( )

A. 标准状况下,11.2 L N2H4中含电子总数为5NA
B. 标准状况下,22.4 L N2H4中所含原子总数为6NA
C. 标准状况下,3.2 g N2H4中含有共价键的总数为0.6NA
D. 若生成3.6 g H2O,则反应转移电子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com