
【题目】如图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是( )

A.电池工作的过程中,溶液中SO![]() 浓度基本不变
浓度基本不变
B.电池工作时,溶液中SO![]() 向c移动
向c移动
C.c为负极,发生氧化反应
D.电池工作的过程中,c电极上产生气泡
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
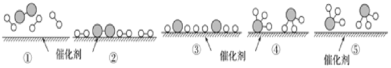
A.使用催化剂,改变了反应的途径,使合成氨反应放出的热量减少
B.该过程中,N2、H2吸收能量后断键形成N原子和H原子
C.该过程中,N原子和H原子形成含有非极性键的NH3分子
D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型: C、D为同周期元素,C核外电子总数是最外层层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________(填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是____________(填分子式);A和B的氢化物所属的晶体类型分别为___________和___________。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为____________,中心原子的杂化轨道类型为________________。
(4)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为______________。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为________;晶胞中A原子的配位数为____________;列式计算晶体F的密度(g cm-3 )__________。
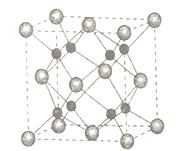
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。
为了进一步研究硫酸铜的用量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。(假设混合溶液总体积等于混合前各溶液的体积之和)
实验 混合溶液 | A | B | C | D | E | F |
4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
请回答下列问题:
①请完成此实验设计,其中:V3=___,V8=___;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___。
③实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率υ(H2SO4)=___(忽略反应前后溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.5L的密闭容器中通入2molX2和3molY2的混合气体,在一定条件下发生反应:X2(g)+3Y2(g) ![]() 2Z(g) +4W(?) ΔH<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量)。
2Z(g) +4W(?) ΔH<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量)。
(1)该反应的化学平衡常数值为_______
(2)为提高X2的平衡转化率,下列措施可行的是___________
a.向体系中再通入一定量的X2
b.降温
c.移出部分Z
d.再冲入一定量Ar e.增大容器体积
(3)反应达平衡后,t1时刻改变条件,速率随时间变化如图所示,则t1对应条件改变为_______

a. 升温
b. 向体系中再通入一定量的W
c. 移走部分X2、Y2
d.减小容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法不正确的是( )
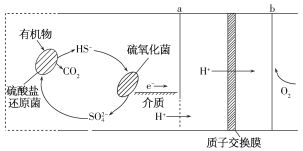
A.电子从a流出,经外电路流向b
B.HS-在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-= SO42- +9H+
C.如果将反应物直接燃烧,能量的利用率不会变化
D.若该电池电路中有0.4mol电子发生转移,则有0.4molH+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
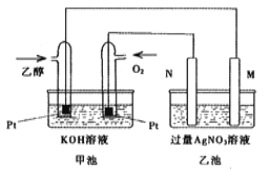
【题目】在298 K时,1 mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8 kJ。
(1)写出该反应的热化学方程式:________________________________________。
(2)如图将此反应设计为原电池,乙池中的两个电极一个是石墨电极,一个是铁电极。工作时M、N两个电极的质量都不减少,乙池中总反应的化学方程式为:_________________,一段时间后,测得乙池中某一电极质量增加4.32g时,理论上甲池消耗氧气体积为(标准状况)__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g) ![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
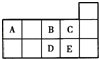
A. D在过量的B中燃烧的主要产物为DB3
B. D的两种常见氧化物均为极性分子
C. AC4 分子的空间立体构型为正四面体形
D. E的氧化物对应的水化物一定是一种强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com