
【题目】在298 K时,1 mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8 kJ。
(1)写出该反应的热化学方程式:________________________________________。
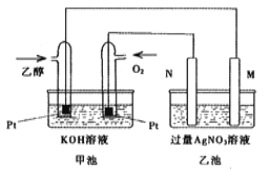
(2)如图将此反应设计为原电池,乙池中的两个电极一个是石墨电极,一个是铁电极。工作时M、N两个电极的质量都不减少,乙池中总反应的化学方程式为:_________________,一段时间后,测得乙池中某一电极质量增加4.32g时,理论上甲池消耗氧气体积为(标准状况)__________mL。
【答案】C2H5OH(l)+3O2(g)=2CO2 (g)+3H2O(l) △H=-1366.8 kJ·mol-1 4AgNO3 + 2H2O![]() 4Ag + O2 ↑+ 4HNO3 224
4Ag + O2 ↑+ 4HNO3 224
【解析】
(1)书写热化学方程式一定要注意标明物质的聚集状态,反应热的单位要写清楚;
(2)由图可知,甲池为原电池,通入乙醇的电极是负极,通入氧气的电极是正极,乙池为电解池,根据图片知,N是阳极,M是阴极,工作时M、N两个电极的质量都不减少,则M电极是铁,N电极是石墨。
(1)1mol乙醇(C2H5OH)完全燃烧并生成二氧化碳和液态水时,放出热量为1366.8kJ,燃烧热的热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8 kJmol-1,故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8 kJmol-1;
(2)乙池为电解池,阳极N极上水失电子发生氧化反应生成氧气,电极反应式为4OH—-4e—=O2↑+2H2O,阴极M上银离子得电子发生还原反应生成银,电极反应式为为Ag++e—=Ag,则电解总反应的化学方程式为4AgNO3 + 2H2O![]() 4Ag + O2↑+ 4HNO3;4.32gAg的物质的量为
4Ag + O2↑+ 4HNO3;4.32gAg的物质的量为![]() =0.04mol,由得失电子数目守恒可知上甲池消耗氧气体积V(O2)=
=0.04mol,由得失电子数目守恒可知上甲池消耗氧气体积V(O2)=![]() ×0.04mol×22.4L/mol=0.224L=224ml,故答案为:4AgNO3 + 2H2O
×0.04mol×22.4L/mol=0.224L=224ml,故答案为:4AgNO3 + 2H2O![]() 4Ag + O2↑+ 4HNO3;224。
4Ag + O2↑+ 4HNO3;224。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为10L的密闭容器中,3molX和1molY进行应:2X(g)+Y(g)![]() Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
A. 以X浓度变化表示的反应速率为0.01mol/(L·s)
B. 将容器体积变为20L,Z的平衡浓度为原来的1/2
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大___min(填0~1、1~2、2~3、3~4、4~5),原因是____。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是(________)
A.蒸馏水
B.KCl溶液
C.KNO3溶液
D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
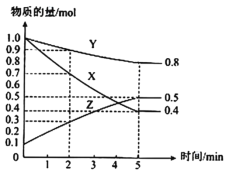
①该反应的化学方程式是___。
②该反应达到平衡状态的标志是___。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成1molY的同时生成2molZ
③2min内X的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是( )

A.电池工作的过程中,溶液中SO![]() 浓度基本不变
浓度基本不变
B.电池工作时,溶液中SO![]() 向c移动
向c移动
C.c为负极,发生氧化反应
D.电池工作的过程中,c电极上产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于容积为2L的恒容密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末该反应达到平衡,测得生成0.8molD和0.4molC。下列判断正确的是( )
xC(g)+2D(g)。2min末该反应达到平衡,测得生成0.8molD和0.4molC。下列判断正确的是( )
A.x=2
B.2min时,A的浓度为0.9mol·L-1
C.2min内B的平均反应速率为0.3mol·L-1·min-1
D.B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭常用的高能燃料,常温下为液体,其球棍模型如下图,肼与双氧水反应:N2H4+2H2O2 = N2↑+4H2O 。下列说法正确的是( )

A. 标准状况下,11.2 L N2H4中含电子总数为5NA
B. 标准状况下,22.4 L N2H4中所含原子总数为6NA
C. 标准状况下,3.2 g N2H4中含有共价键的总数为0.6NA
D. 若生成3.6 g H2O,则反应转移电子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数由小到大的四种短周期元素,其中X、Z、W可分别与氢元素组成共价化合物XH3、H2Z和HW;Y与氧元素可组成离子化合物Y2O和Y2O2。
(1)写出Y2O的电子式:__,Y2O2含有的化学键类型是___。
(2)W元素在元素周期表中的位置是第__周期第__族。
(3)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应,该化合物在实验室制备的化学反应方程式为:__。
(4)水的沸点比H2Z要__(填“高”或者“低”),原因是__。
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子的稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代文化蕴藏了很多化学知识,下列有关说法不正确的是
A. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D. “丹砂(HgS)烧之成水银,积变又还成丹砂”描述的是分解反应和化合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。回答问题:
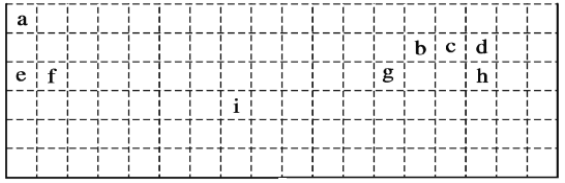
(1)有人认为在元素周期表中,有一种元素也可以放在第ⅦA族,你认为该元素为___(填元素符号)。
(2)实验室制ca3的化学反应方程式为_______________。
(3)g的氧化物与e的最高价氧化物对应水化物反应的离子方程式为_____________。
(4)设计实验验证b、c非金属性的强弱 _________________。
(5)i在周期表中的位置为___。i对应的单质与h对应的单质反应的化学方程式为_________。
(6)e2d2的电子式为______;用电子式表示fCl2的形成过程________________。
(7)写出工业冶炼元素g的单质的化学方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com