
【题目】在一定条件下,将3molA和1molB两种气体混合于容积为2L的恒容密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末该反应达到平衡,测得生成0.8molD和0.4molC。下列判断正确的是( )
xC(g)+2D(g)。2min末该反应达到平衡,测得生成0.8molD和0.4molC。下列判断正确的是( )
A.x=2
B.2min时,A的浓度为0.9mol·L-1
C.2min内B的平均反应速率为0.3mol·L-1·min-1
D.B的转化率为60%
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
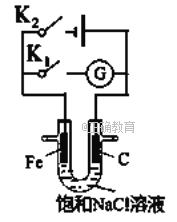
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-QkJ·mol-1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH=-QkJ·mol-1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
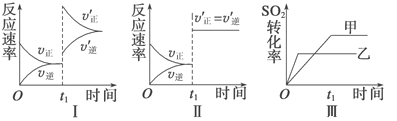
A. 图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响
C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.5L的密闭容器中通入2molX2和3molY2的混合气体,在一定条件下发生反应:X2(g)+3Y2(g) ![]() 2Z(g) +4W(?) ΔH<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量)。
2Z(g) +4W(?) ΔH<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量)。
(1)该反应的化学平衡常数值为_______
(2)为提高X2的平衡转化率,下列措施可行的是___________
a.向体系中再通入一定量的X2
b.降温
c.移出部分Z
d.再冲入一定量Ar e.增大容器体积
(3)反应达平衡后,t1时刻改变条件,速率随时间变化如图所示,则t1对应条件改变为_______

a. 升温
b. 向体系中再通入一定量的W
c. 移走部分X2、Y2
d.减小容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是( )
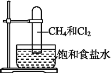
A.此反应无光照也可发生
B.甲烷和Cl2反应后的产物只有CH3Cl和HCl
C.CH4和Cl2完全反应后液面上升,液体充满试管
D.盛放饱和食盐水的水槽底部会有少量晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
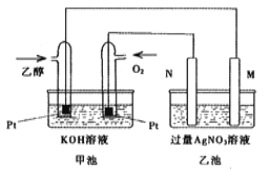
【题目】在298 K时,1 mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8 kJ。
(1)写出该反应的热化学方程式:________________________________________。
(2)如图将此反应设计为原电池,乙池中的两个电极一个是石墨电极,一个是铁电极。工作时M、N两个电极的质量都不减少,乙池中总反应的化学方程式为:_________________,一段时间后,测得乙池中某一电极质量增加4.32g时,理论上甲池消耗氧气体积为(标准状况)__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】傅克反应是合成芳香族化合物的一种重要方法。有机物a(-R为烃基)和苯通过傳克反应合成b的过程如下(无机小分子产物略去)

下列说法错误的是
A. 一定条件下苯与氢气反应的产物之一环己烯与螺[2.3]己烷![]() 互为同分异构体
互为同分异构体
B. b的二氯代物超过三种
C. R为C5H11时,a的结构有3种
D. R为C4H9时,1molb加成生成C10H20至少需要3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,则该反应是_____________(填“吸热”或“放热”)反应,其能量变化可用图中的____________(填“B”或“C”)表示。

(2)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应___________(填“放出”或“吸收”)________kJ 的热量。
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应_____________________。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列7种化学符号:18O;14C;23Na;14N;32S;16O;1H2
(1)表示核素的符号共______种。
(2)互为同位素的是______和______。
(3)质量数相等,但不能互为同位素的是______和______。
(4)中子数相等,但质子数不相等的是______和______。
II.(1)写出下列物质的电子式: NH3 _____________, CO2______。
(2)2.2g铵根![]() 的中子数是___,核外电子数是____,某微粒含有一个原子核,核中有 17个质子,20个中子,核外有18个电子,该粒子的化学符号是____。
的中子数是___,核外电子数是____,某微粒含有一个原子核,核中有 17个质子,20个中子,核外有18个电子,该粒子的化学符号是____。
(3)已知断开 1mol H—H 键、1mol I—I 键、1mol H—I 键分别需要吸收的能量为 436kJ、151kJ、299kJ,则由 1mol H2和 1mol I2生成 2mol HI会_____(“放出”或“吸收”)_____kJ 的热量。
(4)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S,只由离子键构成的物质是_____(填序号,下同),由离子键和非极性共价键构成的物质是________,属于共价化合物的是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com