
【题目】我国古代文化蕴藏了很多化学知识,下列有关说法不正确的是
A. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D. “丹砂(HgS)烧之成水银,积变又还成丹砂”描述的是分解反应和化合反应
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型: C、D为同周期元素,C核外电子总数是最外层层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________(填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是____________(填分子式);A和B的氢化物所属的晶体类型分别为___________和___________。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为____________,中心原子的杂化轨道类型为________________。
(4)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为______________。
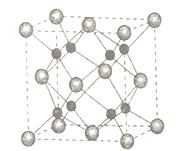
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为________;晶胞中A原子的配位数为____________;列式计算晶体F的密度(g cm-3 )__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298 K时,1 mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8 kJ。
(1)写出该反应的热化学方程式:________________________________________。
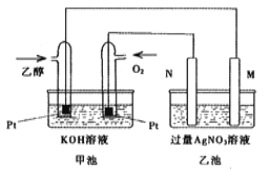
(2)如图将此反应设计为原电池,乙池中的两个电极一个是石墨电极,一个是铁电极。工作时M、N两个电极的质量都不减少,乙池中总反应的化学方程式为:_________________,一段时间后,测得乙池中某一电极质量增加4.32g时,理论上甲池消耗氧气体积为(标准状况)__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g) ![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,则该反应是_____________(填“吸热”或“放热”)反应,其能量变化可用图中的____________(填“B”或“C”)表示。

(2)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应___________(填“放出”或“吸收”)________kJ 的热量。
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应_____________________。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
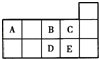
A. D在过量的B中燃烧的主要产物为DB3
B. D的两种常见氧化物均为极性分子
C. AC4 分子的空间立体构型为正四面体形
D. E的氧化物对应的水化物一定是一种强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:

回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。

(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为________。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。

①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(Na2S)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为___________,与粗硒中铁含量为0.89%相比,铁含量明显降低。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com