
| A. | ③④⑤⑧ | B. | ④⑤⑧ | C. | ③④⑤⑦⑧ | D. | ④⑦⑧ |
分析 含碳碳双键、三键、-CHO的有机物既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,以此来解答.
解答 解:①甲烷与高锰酸钾、溴水均不反应,故不选;
②苯与高锰酸钾、溴水均不反应,故不选;
③聚乙烯不含碳碳双键,与高锰酸钾、溴水均不反应,故不选;
④2-丁炔中含碳碳三键,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故选;
⑤乙醇与溴水不反应,故不选;
⑥邻二甲苯与溴水不反应,故不选;
⑦环己烯中含碳碳双键,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故选;
⑧乙醛中含-CHO,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故选;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到金属的单质 | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能生成H+的化合物是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硝酸钠外观与食盐相似 | |
| B. | 亚硝酸钠和食盐一样也具有咸味 | |
| C. | 食盐可用作食品的添加剂而亚硝酸钠绝对不可用作食品添加剂 | |
| D. | 亚硝酸钠溶液和食盐溶液中滴加硝酸银溶液均可产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 向100mL 3mol/L NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得溶液的pH>7.
向100mL 3mol/L NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得溶液的pH>7.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 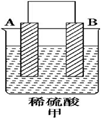 |  | 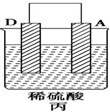 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 5:3 | C. | 3:5 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁条与稀盐酸反应:Mg+2H+═H2↑+Mg 2+ | |
| B. | 铝丝与硫酸铜溶液反应:Al+Cu 2+═Al 3++Cu | |
| C. | 铜丝与硝酸银溶液反应:Cu+2Ag+═2Ag+Cu 2+ | |
| D. | 锌和氯化铜溶液反应:Zn+Cu2+═Zn 2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | X、Y、Z三种元素的单质中,Z单质的氧化性最强 | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2、CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com