
【题目】t℃时,AgCl(s)与AgI(s)分别在溶液中达到沉淀溶解平衡,相关离子浓度的关系如下图所示。下列说法正确的是

A. 曲线Y表示![]() 与
与![]() 的变化关系
的变化关系
B. t℃时,向Z点对应的溶液中加入蒸馏水,可使溶液变为曲线X对应的饱和溶液
C. t℃时,AgCl(s)+I-(aq)![]() AgI(s)+Cl-(aq)的平衡常数K=1×103
AgI(s)+Cl-(aq)的平衡常数K=1×103
D. t℃时,向浓度均为0.1mol/ L的KI与KCl混合溶液中加入AgNO3溶液,当Cl-刚好完全沉淀时,此时c(I-) = 1×10-11 mol/L
【答案】D
【解析】A. ![]() =16时
=16时![]() ,Ksp=
,Ksp=![]() ,
, ![]() =10时
=10时![]() ,Ksp=
,Ksp=![]() ,由于碘化银的溶度积小于氯化银,故曲线Y表示
,由于碘化银的溶度积小于氯化银,故曲线Y表示![]() 与
与![]() 的变化关系,选项A错误;B. t℃时,向Z点对应的溶液中加入蒸馏水,银离子浓度及卤离子浓度均减小,
的变化关系,选项A错误;B. t℃时,向Z点对应的溶液中加入蒸馏水,银离子浓度及卤离子浓度均减小, ![]() 与
与![]() 均增大,可使溶液变为曲线Y对应的饱和溶液,选项B错误;C、t℃时,AgCl(s)+I-(aq)
均增大,可使溶液变为曲线Y对应的饱和溶液,选项B错误;C、t℃时,AgCl(s)+I-(aq)![]() AgI(s)+Cl-(aq)的平衡常数K=
AgI(s)+Cl-(aq)的平衡常数K=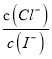 =
=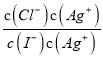 =
=![]() =1×106,选项C错误;D、t℃时,向浓度均为0.1mol/ L的KI与KCl混合溶液中加入AgNO3溶液,当Cl-刚好完全沉淀时,c(Cl-) = 1×10-5 mol/L,c(Ag+) =
=1×106,选项C错误;D、t℃时,向浓度均为0.1mol/ L的KI与KCl混合溶液中加入AgNO3溶液,当Cl-刚好完全沉淀时,c(Cl-) = 1×10-5 mol/L,c(Ag+) = ![]() =1×10-5 mol/L,此时c(I-) =
=1×10-5 mol/L,此时c(I-) = ![]() =1×10-11 mol/L,选项D正确。答案选D。
=1×10-11 mol/L,选项D正确。答案选D。


科目:高中化学 来源: 题型:
【题目】下列关于各装置图的叙述中,不正确的是( )
A.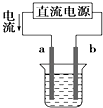 如图装置中a为阳极、b为阴极
如图装置中a为阳极、b为阴极
B.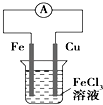 如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+
如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.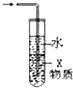 如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D. 如图装置中的铁钉几乎不被腐蚀
如图装置中的铁钉几乎不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年度的诺贝尔化学奖分别奖给美国和法国的三位科学家,表彰他们对“烯烃复分解”反应研究方面作出的贡献。“烯烃复分解”是指在金属钨或钼等催化剂的作用下,碳碳双键断裂并重新组合的过程。例如:

则对于有机物CH2=CHCH2CH=CH2发生烯烃复分解反应时可能生成产物的判断中正确的是( )
①![]() ;②CH2=CH2;③
;②CH2=CH2;③![]() ;④CH2=C=CH2
;④CH2=C=CH2
A. 只有①②③ B. 只有①② C. 只有③ D. 只有③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)D在周期表中的位置___________;
(2)元素C、D、E形成的原子半径大小关系是______________(用元素符号表示)。
(3)C、D可形成化合物D2C2,D2C2含有的化学键类型有______________________;
(4)A、C两种元素形成的原子个数之比为1:1的化合物电子式________________;
(5)B的氢化物与B的最高价氧化物的水化物反应的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】方铅矿的主要成分为PbS,含铅可达86.6%。以方铅矿为原料制备铅蓄电池的电极材料PbO2的工艺流程如图所示:

(1)方铅矿焙烧后排出气体的主要成分是______(填化学式),可用于工业制备________。
(2)步骤②中焦炭的作用是________。
(3)“粗铅”的杂质主要有锌、铁、铜、银等。电解精炼时,________作阴极,阴极反应式为________,阳极泥的主要成分是________。
(4)步骤⑤中制备PbO2的离子方程式________。
(5)已知:常温下,Ksp(PbS)=8×10-28、Ka1(H2S)=1.3×10-7、Ka2(H2S)=7.1×10-15。常温下,向Pb(NO3)2溶液中通入H2S气体,发生反应的离子方程式是________;结合数据分析,该反应能否进行得基本完全?________(写出计算推理过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为112的有机物X完全燃烧只生成CO2和H2O,若X含一个六元碳环且可以发生银镜反应,则环上一溴代物的种类为( )
A.2
B.3
C.4
D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000mol/L(NH4)2SO4溶液中逐滴加入0.2000mol/LNaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
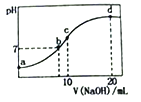
A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
B. 点b所示溶液中: c(NH4+)=c(Na+)> c(H+)= c(OH-)
C. 点c所示溶液中:c(NH3·H2O)+ c(OH-)= c(H+)+ c(SO42-)
D. 点d所示溶液中: c(SO42-)> c(NH3·H2O)> c(OH-)> c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天飞船高速进入大气层后,温度会迅速升高,其表层的复合材料可保护飞船不受破坏。这体现了该复合材料具有的特点是
A. 耐酸性 B. 耐热性 C. 耐腐蚀 D. 耐碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com