
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| c(CO)c(H 2O) |
| c(CO 2)c(H 2) |
| c(CO)c(H2O) |
| c(CO2)c(H 2) |
| 0.75×1.5 |
| 1×1.2 |


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
| A、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为防止富脂食品氧化变质,常在包装袋中放入生石灰 |
| B、“天宫一号”中使用的碳纤维,是一种新型无机非金属材料 |
| C、用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
| D、汽车排放的尾气和冬季取暖排放颗粒污染物是形成雾霾的重要因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
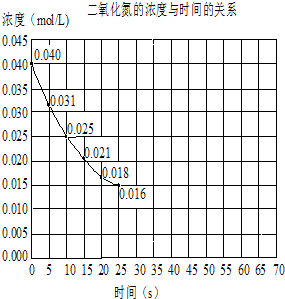 二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡NO2浓度约为0.0125mol/L.如图中的曲线表示二氧化氮分解反应在前25s内的反应进程.
二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡NO2浓度约为0.0125mol/L.如图中的曲线表示二氧化氮分解反应在前25s内的反应进程.查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.24 | 0.24 | 0.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用酚酞溶液鉴别稀盐酸和稀氢氧化钠溶液 |
| B、用燃着的木条鉴别CO2和O2 |
| C、用稀硫酸鉴别锌片和铜片 |
| D、用加水溶解的方法即可鉴别食盐和白糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用淀粉溶液鉴别NaBr、KI溶液 |
| B、用KMnO4酸性溶液鉴别CH4、C2H4气体 |
| C、用AgNO3溶液鉴别Na2SO4、NaCl溶液 |
| D、用澄清石灰水鉴别Na2CO3、NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海带中提取碘单质的过程不涉及氧化还原反应 |
| B、往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 |
| C、赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的 |
| D、虽然海水中元素的种类很多,总储量很大,但许多元素的富集程度很低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com