
| A、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |


科目:高中化学 来源: 题型:
| A、标准状况下,1 mol水的体积约为22.4 L |
| B、含有2 mol氧原子的氧单质在标准状况下占有的体积一定是22.4 L |
| C、1 mol气体只有在标准状况下的体积才是22.4 L |
| D、标准状况下,2 L二氧化碳和3 L一氧化碳所含有的原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg和Al |
| B、Al和Fe |
| C、Fe和Zn |
| D、Zn和Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
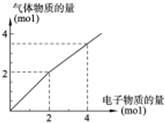 用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如图所示(不考虑氯气的溶解).若电解结束时,通过电子总物质的量为4mol,电解后恢复至常温,溶液的体积为2L,则混合气体中氢气的物质的量为
用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如图所示(不考虑氯气的溶解).若电解结束时,通过电子总物质的量为4mol,电解后恢复至常温,溶液的体积为2L,则混合气体中氢气的物质的量为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 |
| B、研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 |
| C、开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料 |
| D、实现资源的“3R”利用,即:减少资源消耗、增加资源的重复使用、资源的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、2:1 |
| C、略大于1:2 | D、略大于2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、铁为阳极,H2SO4为电解液 |
| B、阴极发生的电极反应为6H2O+6e-═3H2↑+6OH- |
| C、阳极附近溶液pH变大 |
| D、铁失去3mol电子可以在阴极得到33.6L氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
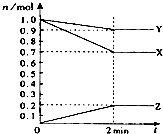 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com