
| A、Mg和Al |
| B、Al和Fe |
| C、Fe和Zn |
| D、Zn和Cu |
| 11.2L |
| 22.4L/mol |
| 20g |
| 0.5mol |
| 2 |
| 3 |
| 2 |
| 3 |


科目:高中化学 来源: 题型:
| A、上述四种元素的原子半径大小为Y<X<W |
| B、W、X、Y原子的核外最外层电子数的总和为10 |
| C、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
| D、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸氢钠的水解 | HCO3-+H2O?H3O++CO32- | 正确 |
| B | 向FeCl3溶液中加入铜粉 | Cu+Fe3+═Cu2++Fe2+ | 错误,电荷不守恒 |
| C | “84消毒液”(有效成分为NaClO溶液)和“洁厕灵” (有成分为浓盐酸)混合放 出氯气 | ClO-+Cl-+H+═Cl2↑+OH- | 正确 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | 错误,Fe2+与Br- 的物质的量之比与化学式不符 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
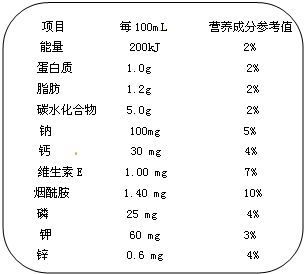
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲>乙>丙 |
| B、甲=乙=丙 |
| C、乙>甲>丙 |
| D、甲>丙>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
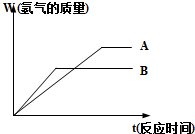 等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:| 实验序号 | 甲 | 乙 | 丙 |
| 混合粉末质量(g) | 6.2 | 18.6 | 24.8 |
| 生成气体气体(mL) | 2240 | 5600 | 5600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.8 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com