
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.24 | 0.24 | 0.24 |
| 0.16mol |
| 2L |
| 0.28mol |
| 2L |
| ||
| 20s |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
| 0.242 |
| 0.08 |
| c2(NO2) |
| c(N2O4) |


科目:高中化学 来源: 题型:
| A、1:2 | B、2:1 |
| C、略大于1:2 | D、略大于2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器Ⅰ、Ⅱ中正反应速率相同 |
| B、容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C、容器Ⅰ中CO 的转化率与容器Ⅱ中CO2 的转化率之和等于1 |
| D、容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏常用于分离提纯液态有机混合物 |
| B、核磁共振氢普通常用于分析有机物的相对分子质量 |
| C、燃烧法是研究确定有机物成分的有效方法 |
| D、对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KHCO3 |
| B、K2CO3和Na2CO3 |
| C、MgCO3和Na2CO3 |
| D、Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12% | B、78% |
| C、72% | D、13% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚乙烯塑料的老化是由于发生了加成反应 |
| B、合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
C、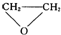 和CO2反应生成可降解聚合物[O-CHCH2-O-CO]n,该反应符合绿色化学的原则 和CO2反应生成可降解聚合物[O-CHCH2-O-CO]n,该反应符合绿色化学的原则 |
| D、煤经过气化和液化等物理变化可以转化为清洁燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com