
下列说法正确的是
| A.7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 |
| B.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0×6.02×1023 |
| C.2.24LSO2与O2混合气体中所含氧原子数为0.2×6.02×1023 |
| D.Vlamol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:单选题
将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气 L L |
B.反应后溶液中的Cl―数目为: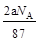 |
C.NA可表示为: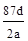 |
D.反应后溶液中的H+数目为: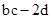 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况)。则原混合物中Na2O2和NaHCO3的物质的量之比为
| A.3:2 | B.2:1 | C.8:1 | D.2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.相同物质的量的O2和O3,体积相同 |
| B.离子化合物一定含有离子键,可能含有共价键 |
| C.由盐酸的酸性强于氢硫酸的酸性,可推知氧化性:Cl2>S |
| D.常温下,等体积、pH均为3的醋酸和硫酸分别与完全相同的镁条反应,硫酸产生氢气速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.在反应KIO3 + 6 HI=KI + 3I2+3 H2O中,每生成3mo1 I2转移的电子数为5NA |
| B.100mL 18.4mo1·L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA |
| C.1L 0.1 moI·L-1的CH3COOH溶液中所含的离子和分子总数为0.1NA |
| D.将0.lmol FeC13滴人沸水中可制得0.1NA Fe(OH)3胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(8分)(1)2 mol O3和3 mol O2的质量之比________,体积之比________.
(2)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是________ X的相对原子质量是________.
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
三草酸合铁酸钾晶体[K3Fe(C2O4)3?xH2O]是一种光敏材料,为测定该晶体中草酸根的含量和结晶水的含量,某实验小组实验步骤为:(1)称量9.820 g三草酸合铁酸钾晶体,配制成250 mL溶液。(2)取所配溶液25.00 mL于锥形瓶中,滴加酸性KMnO4溶液至C2O42-全部转化成CO2,同时MnO4-被转化成Mn2+,恰好消耗0. 1000 mol/L KMnO4溶液24.00 mL。[K3Fe(C2O4)3的相对分子质量为437] 下列说法正确的是
| A.步骤(2)中KMnO4表现还原性 |
| B.配制三草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒 |
| C.样品中结晶水的物质的量为0.03 mol |
| D.该晶体的化学式为K3Fe(C2O4)3?3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.2mol/L。若向该混合溶液中加入足量的铜粉。则最多能溶解铜粉的质量为
| A.2.4 g | B.3.2 g | C.6.4 g | D.9.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下某容器中各微粒在反应前后的变化如图所示,其中●和○代表不同元素的原子。关于此反应说法错误的是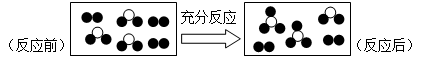
| A.一定属于可逆反应 | B.一定属于化合反应 |
| C.一定属于氧化还原反应 | D.一定属于放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com