
【题目】(1)25℃时,0.1mol L-1NaOH溶液中,Kw=__;pH=__。
(2)氯化铁水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):__。实验室在配制氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了___(填“促进”、“抑制”)氯化铁水解。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈__(填“酸性”,“中性”或“碱性”),溶液中c(Na+ )___c(CH3COO-)(填“>”,“=”或“<”)。
【答案】1.0×10-14 13 酸性 Fe3+ +3H2O![]() Fe(OH)3 +3H+ 抑制 酸性 <
Fe(OH)3 +3H+ 抑制 酸性 <
【解析】
(1)根据Kw的影响因素进行判断,pH=-lg(H+)进行计算;
(2)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性;为防止氯化铁水解,在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,抑制其水解。
(3)醋酸为弱电解质,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合,醋酸过量,溶液呈酸性。
(1)25℃时任何水溶液的Kw都为1.0×10-14,0.1mol L-1NaOH溶液中c(OH-)=0.1mol/L,c(H+)=![]() 1.0×10-13mol/L,PH=-lg(H+)=13,
1.0×10-13mol/L,PH=-lg(H+)=13,
故答案为:1.0×10-14 ; 13;
(2)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3+ +3H2O![]() Fe(OH)3 +3H+;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,
Fe(OH)3 +3H+;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,
故答案为:酸;Fe3+ +3H2O![]() Fe(OH)3 +3H+;抑制;
Fe(OH)3 +3H+;抑制;
(3)醋酸为弱电解质,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合,醋酸过量,溶液呈酸性,则c(H+)>c(OH),溶液中存在:c(CH3COO)+c(OH)=c(Na+)+c(H+),则c(Na+)<c(CH3COO),
故答案为:酸性; <。


科目:高中化学 来源: 题型:
【题目】数十年来,化学工作者对氮的氧化物、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g) ![]() N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) ![]() 2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①2NO(g)+O2(g) ![]() 2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
②一定温度下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
II.利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放(1)已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。
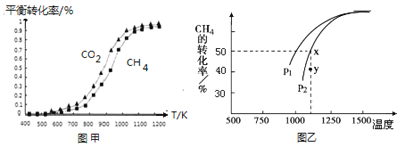
同温度下CO2的平衡转化率________(填“大于”“小于”或“等于”)CH4的平衡转化率。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) ![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
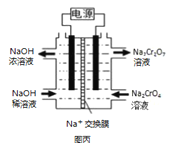
III.根据2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是

A. 在0~50 min之间,R的降解百分率pH=2大于pH=7
B. 溶液酸性越强,R的降解速率越大
C. R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响
D. 在20~25 min之间,pH=10时R的降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为1L的密闭容器中(体积不变)充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是( )
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是( )

A.进行到3分钟时,正反应速率和逆反应速率相等
B.10分钟后容器中各物质浓度不再改变
C.达到平衡后,升高温度,正反应速率增大、逆反应速率减小
D.10min内用H2的浓度变化表示的平均反应速率为0.075mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
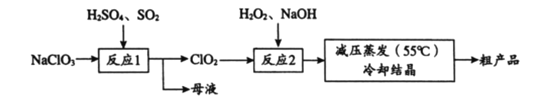
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种染料敏化太阳能电池的示意图,电池的一个电极由有机光敏染料(R)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,下列关于该电池叙述不正确的是( )

A.染料敏化TiO2电极为电池负极,发生氧化反应
B.正极电极反应式是:I3-+2e-=3I-
C.电池总反应是:2R++3I-=I3-+2R
D.电池工作时将太阳能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取6.0 g铝土矿样品(主要成分为Al2O3,含Fe2O3杂质),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )

A. 3.50 mol·L-1
B. 1.75 mol·L-1
C. 0.85 mol·L-1
D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室如图的装置模拟工业过程制取硫代硫酸钠(夹持仪器和加热仪器均省略)。其反应原理为2Na2S+Na2CO3+4SO2![]() 3Na2S2O3+CO2
3Na2S2O3+CO2

请回答:
(1)下列说法不正确的是___。
A.装置A的烧瓶中的试剂应是Na2SO3固体
B.提高C处水浴加热的温度,能加快反应速率,同时也能增大原料的利用率
C.装置E的主要作用是吸收CO2尾气
D.装置B的作用之一是观察SO2的生成速率,该处锥形瓶中可选用浓硫酸或饱和NaHSO3溶液
(2)反应结束后C中溶液中会含有少量Na2SO4杂质,请解释其生成原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两气体A、B分别为0.6mol、0.5mol。在0.4L密闭容器中发生反应:3A+B![]() mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率 为0.1mol·L-1·min-1,以下结论正确的是( )
mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率 为0.1mol·L-1·min-1,以下结论正确的是( )
A.m值为3B.B的转化率为20%
C.A的平均反应速率为0.1mol·L-1·min-1D.平衡时反应混合物总物质的量为1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com