
【题目】燃煤工业锅炉烟气中含有1%-3%的CO和0.02%~0.04%的NO,在新型催化剂作用下可消除CO和NO两种有害气体,反应机理如图所示,在反应过程中CO可被O2氧化。下列说法中正确的是
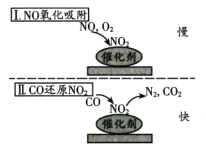
A.温度越高越有利于有害气体消除
B.O2浓度越大催化除杂效果越好
C.催化反应的速率由氧化吸附过程决定
D.总反应方程式为2NO+2CO=N2+2CO2
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2N2O4(g)+N2O(g)![]() 3N2O3(g),若反应开始时充入2molN2O4和2mol N2O,达平衡后N2O4的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后N2O4的体积分数大于a%的是( )
3N2O3(g),若反应开始时充入2molN2O4和2mol N2O,达平衡后N2O4的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后N2O4的体积分数大于a%的是( )
A.2molN2O3
B.2mol N2O4、2molN2O和1molHe(不参加反应)
C.1molN2O和1molN2O3
D.2molN2O4、3molN2O和3molN2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有168g NaHCO3 固体,加热到质量不再变化为止,试计算:
(1)剩余固体的质量(m);__________
(2) (标准状况下)产生气体的体积v。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芘经氧化后可用于染料合成。芘的一种转化路线如图所示,下列叙述正确的是
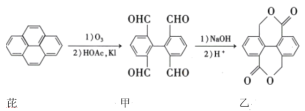
A.芘的一氯代物有4种
B.甲分子中所有碳原子一定都在同一平面上
C.lmol乙与足量NaOH溶液反应,最多消耗2molNaOH
D.甲催化氧化后,再发生酯化反应也能得到乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象能得到相应结论的是
选项 | 实验操作和现象 | 结 论 |
A | 向苯酚钠溶液中通入足量CO2溶液变浑浊 | 酸性:H2CO3>C6H5OH>HCO3- |
B | 向KBrO3溶液中通入少量Cl2然后再加入少量苯,有机层呈橙红色 | 氧化性:Cl2>Br2 |
C | 将等浓度等体积的KI溶液和FeCl3溶液混合,充分反应后滴入KSCN溶液,溶液变红 | 溶液中存在平衡: 2Fe3++2I- |
D | 向2支均盛有2mL相同浓度银氨溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀 | Ksp(Agl)>Ksp(AgCl) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、镁、铝、铁是四种重要的金属。请回答:
(1)钠的熔点比铁的熔点__________(填“高”或“低”)。
(2)将一小块金属钠投入水中,发生反应的离子方程式为__________________。
(3)若D为上述四种金属单质中的一种;A、B为气体单质,其中A为黄绿色气体,B为无色气体;C为化合物,其水溶液显酸性;F的水溶液遇到KSCN溶液会呈现血红色。它们之间有下列转化关系:
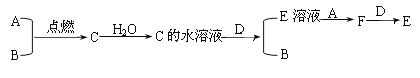
①将紫色石蕊试液滴入A的饱和溶液中,实验现象为___________________。
②写出C的水溶液与D反应的离子方程式:________________________。
③在F的水溶液加入D,反应的离子方程式是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。预计在未来20年里,不可能有替代钕铁硼磁铁的磁性材料出现。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其它稀土原料。
(1)钕(Nd)为60号元素,在元素周期表中的位置是___;
(2)实验测得气态A1C13的实际存在形式为A12C16双聚分子,其中A1原子的杂化方式是___;A12C16与过量NaOH溶液反应生成Na[Al(OH)4];[A1(OH)4]-中存在的化学键有___。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
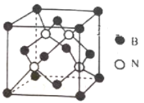
(3)已知立方BN晶体晶胞结构如图所示,设晶胞中最近的B、N原子之间的距离为a nm,晶体的密度为b gcm-3,则阿伏加德罗常数为____mol-1 (列式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.钠与水的反应: Na+2H2O =Na++2OH-+H2↑
B.氯化铵固体与熟石灰共热制氨气:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C.氯气通入石灰乳中制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D.食醋除水垢:CaCO3+ 2CH3COOH = Ca2+ + 2CH3COO- + CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废催化剂中含有多种金属元素,某废催化剂主要含有SiO2、ZnO、ZnS和CuS,为充分利用资源,变废为宝,在实验室中探究回收废催化剂中的锌和铜,具体流程如图所示,回答下列问题:
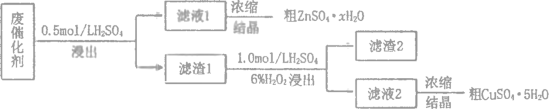
已知:ZnS与稀硫酸反应且化合价不变;CuS既不溶于稀硫酸也不与稀硫酸反应。
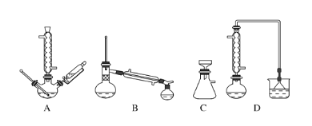
(1)下列玻璃仪器或装置中,第一次浸出时尾气净化需要使用的装置为___________(填标号),“浓缩结晶”需要使用的仪器是_______________(填名称)。
(2)滤渣1的主要成分是 ___________。
(3)第二次浸出时,向盛有滤渣1的反应器中先加入稀硫酸,后滴入过氧化氢溶液。反应器中有淡黄色沉淀生成,写出反应的离子方程式___________;若顺序相反,会造成___________。
(4)第二次浸出时需要加热且控温,采用的合适加热方式是___________。
(5)某同学在实验完成之后,得到23.3g提纯的硫酸锌晶体(ZnSO4·xH2O)。为确定晶体化学式,取5.0g晶体,用蒸馏水完全溶解.再加入足量的氯化钡溶液,充分反应后过滤、___________、___________、称重得固体4.1g,则硫酸锌晶体的化学式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com