
【题目】一定温度下,在恒容密闭容器中发生如下反应:2N2O4(g)+N2O(g)![]() 3N2O3(g),若反应开始时充入2molN2O4和2mol N2O,达平衡后N2O4的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后N2O4的体积分数大于a%的是( )
3N2O3(g),若反应开始时充入2molN2O4和2mol N2O,达平衡后N2O4的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后N2O4的体积分数大于a%的是( )
A.2molN2O3
B.2mol N2O4、2molN2O和1molHe(不参加反应)
C.1molN2O和1molN2O3
D.2molN2O4、3molN2O和3molN2O3
【答案】A
【解析】
反应2N2O4(g)+N2O(g)![]() 3N2O3(g)中,气体的体积前后相同,在一定温度下,在恒容密闭容器中得到平衡状态,只要满足物质全部转化为N2O4、N2O,且满足n(N2O4):n(N2O)=1:1,就是等效平衡,结合浓度对平衡移动的影响,只要加入的物质的量:n(N2O4):n(N2O)>1:1,平衡后N2O4的体积分数大于a%;
3N2O3(g)中,气体的体积前后相同,在一定温度下,在恒容密闭容器中得到平衡状态,只要满足物质全部转化为N2O4、N2O,且满足n(N2O4):n(N2O)=1:1,就是等效平衡,结合浓度对平衡移动的影响,只要加入的物质的量:n(N2O4):n(N2O)>1:1,平衡后N2O4的体积分数大于a%;
A.2molN2O3相当于![]() molN2O4和
molN2O4和![]() molN2O,二者的比值为2:1,大于1:1,则平衡后N2O4的体积分数大于a%,故A正确;
molN2O,二者的比值为2:1,大于1:1,则平衡后N2O4的体积分数大于a%,故A正确;
B.2molN2O4、2molN2O和1molHe(不参加反应),n(N2O4):n(N2O)=2:2,等于1:1,则平衡后N2O4的体积分数等于a%,故B错误;
C.1molN2O和1molN2O3,相当于![]() molN2O4和
molN2O4和![]() molN2O,n(N2O4):n(N2O)=1:2,小于1:1,则平衡后N2O4的体积分数小于a%,故C错误;
molN2O,n(N2O4):n(N2O)=1:2,小于1:1,则平衡后N2O4的体积分数小于a%,故C错误;
D.2molN2O4、3molN2O和3molN2O3,相当于4molN2O4和4molN2O,二者的比值为4:4,等于1:1,则平衡后N2O4的体积分数等于a%,故D错误;
答案为A。


科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A(g)+B(g) ![]() 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
(1)比较a___b(填“>”“=”或“<”)。
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中T1____T2(填“>” “=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度___(填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系_______(用代数式表示)。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是_____。
A.4molA和2molB B.4molA、2molB和2molC C.4molA和4molB D.6molA和4molB
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____。
A.及时分离出C气体 B.适当升高温度 C.增大B的浓度 D.选择高效催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d_____b(填“>”“=”或“<”),理由是_________。
(6)在一定温度下,向一个容积可变的容器中,加入3molA和2molB及固体催化剂,使之反应:2A(g)+B(g)![]() 2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ⅰ.断裂1molN-N键吸收167kJ热量,形成1molN≡N键放出942kJ热量,Ⅱ.N2(g)+3H2(g)![]() 2NH3(g);△H1=-92.2kJmol-1对于反应:N4(g)+6H2(g)
2NH3(g);△H1=-92.2kJmol-1对于反应:N4(g)+6H2(g)![]() 4NH3(g);△H2(kJmol-1),以下说法正确的是( )
4NH3(g);△H2(kJmol-1),以下说法正确的是( )
A.该反应的反应热△H2>0B.N2分子比N4分子更稳定
C.△H2=2△H1D.△H2与方程式系数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
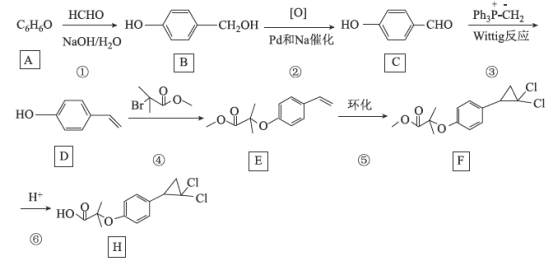
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是
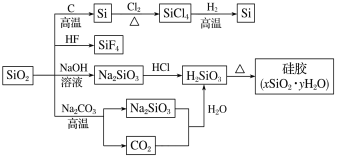
A.SiO2属于两性氧化物B.酸性:H2SiO3>H2CO3
C.硅胶吸水后可重复再生D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() 。若溶液混合引起的体积变化可忽略,则室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
。若溶液混合引起的体积变化可忽略,则室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
C.![]() 的
的![]() 和
和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
D.![]() 氨水和
氨水和![]() 溶液等体积混合:
溶液等体积混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气有下列反应:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
(1)该反应中氧化剂是_____;被还原的元素是_______;氧化产物是 ______;
(2)用单线桥法标出电子转移的方向和数目______________;
(3)若该反应中有0.2mol的电子转移,则能生成标准状况下的氯气的体积是_______;
(4)若该反应有1molKMnO4参加反应,被氧化的HCl为______mol,转移电子数______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤工业锅炉烟气中含有1%-3%的CO和0.02%~0.04%的NO,在新型催化剂作用下可消除CO和NO两种有害气体,反应机理如图所示,在反应过程中CO可被O2氧化。下列说法中正确的是
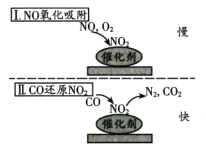
A.温度越高越有利于有害气体消除
B.O2浓度越大催化除杂效果越好
C.催化反应的速率由氧化吸附过程决定
D.总反应方程式为2NO+2CO=N2+2CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com