
����Ŀ��(1)ʯ�ͺ�ú����Ҫ����Դ���ʣ�����˵���������___��
a��ʯ�ͺ�ú�Dz���������Դ
b��úΪ�������б����ױ������ױ����л���
c��ú�ĸ����ʯ�͵ķ����������仯
d��úȼ�ռ�����β������ɿ�����Ⱦ����Ҫԭ��
e����ú��ʯ��Ϊԭ�Ͽ��������ϡ��ϳ����ϳ���ά�Ⱥϳɲ���
(2)��úΪԭ�Ͼ���һϵ�з�Ӧ������������������ϳ�·�����£�
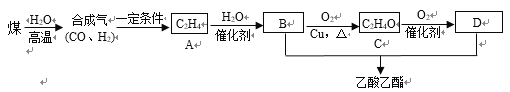
��C��������______��A��B�ķ�Ӧ������_______��
�ھ���������B���ʵĻ���������_________��
��B��C�Ļ�ѧ����ʽΪ_______________________________��
B+D�����������Ļ�ѧ����ʽΪ________________________________��
(3)ij��ѧʵ��С���ͬѧ��������ͼװ����ȡ����������

������B��������_______������A����ȴˮ�Ľ�����_____(����a������b��)��
�ڹ۲�����A���ڲ�ṹ���볤ֱ������Ƚϣ��÷�Ӧװ�õ��ŵ���_______��
�۽��Ҵ������ᰴ�����ʵ���3��2��ϵõ�258g���Һ����Ũ���������·�����Ӧ�����������IJ���Ϊ50%�������ɵ�����������������_______g��(��Է����������Ҵ���46��������60������������88)
���𰸡�bc ��ȩ �ӳɷ�Ӧ �ǻ� 2C2H5OH+O2 ![]() 2CH3CHO + 2H2O CH3COOH + C2H5OH
2CH3CHO + 2H2O CH3COOH + C2H5OH![]() CH3COOC2H5 + H2O ֱ�������ܻ������� a ����Ӵ����������Ч������ 88
CH3COOC2H5 + H2O ֱ�������ܻ������� a ����Ӵ����������Ч������ 88
��������
(1) a��ʯ�ͺ�ú�ǻ�ʯȼ�ϣ�
b��úΪ����ú�ĸ�������к��б����ױ������ױ����л��
c��ú�ĸ���ָú�ڸ������������¼��ȡ��ֽ⣬���ɽ�̿(��뽹)��ú���͡��ֱ���ú���Ȳ���Ĺ��̣�ú�ĸ��������ڻ�ѧ�仯��ʯ�͵ķ����ǽ�ʯ�ͷ��뼸�ֲ�ͬ�е�Ļ�����һ�ַ��������������仯��
d��úȼ�ղ���������������β���к��е������
e�����ϡ��ϳ����ϳ���ά���Ի�ʯȼ��Ϊԭ�Ͼ����ۺϷ�Ӧ�õ��IJ�Ʒ��
(2)ú�ڸ�������ˮ��Ӧ���ɺϳ���(һ����̼������)���ϳ�����һ�������·�Ӧ����A(��ϩ)����ϩ�ڴ�����������ˮ�����ӳ������Ҵ�����BΪ�Ҵ����Ҵ���ͭ����������������������������������Ӧ������ȩ����CΪ��ȩ����ȩ�ڴ�����������������Ӧ��������Ϊ���ᣬDΪ���ᣬB(�Ҵ�)��D(����)����������Ӧ���������������ݴ˷������
(3) �ٸ�����������������ƣ���ȴˮ�½��ϳ���
������A���ڲ�ṹ���볤ֱ������Ƚϣ������������Ӵ������
�۸��ݷ�Ӧ�ͱ�����ϵ���ƶ��Ҵ����������㷴Ӧ��������������ݷ�Ӧ����ʽ���������������������ݲ���=![]() ��������������ʵ�ʲ�����
��������������ʵ�ʲ�����
(1) a��ʯ�ͺ�ú�ǻ�ʯȼ�ϣ���ʯȼ�ϲ�����������a��ȷ��
b��ú����Ҫ�ɷ�Ϊ̼���⡢���������ĵ����������Ԫ�صĸ��ӻ���ú�ĸ�������к��б����ױ������ױ����л����b����
c��ú�ĸ���ָú�ڸ������������¼��ȡ��ֽ⣬���ɽ�̿(��뽹)��ú���͡��ֱ���ú���Ȳ���Ĺ��̣�ú�ĸ��������ڻ�ѧ�仯��ʯ�͵ķ����ǽ�ʯ�ͷ��뼸�ֲ�ͬ�е�Ļ�����һ�ַ��������������仯����c����
d��ú�к�����ȼ�ղ���������������β���к��е���������ɵ������Ϊ������Ⱦ���d��ȷ��
e�����ϡ��ϳ����ϳ���ά���Ի�ʯȼ��Ϊԭ�Ͼ����ۺϷ�Ӧ�õ��IJ�Ʒ����e��ȷ��
��ѡbc��
(2)�ٸ��ݷ�����C����������ȩ��A��B�ķ�Ӧ�����Ǽӳɷ�Ӧ��
��BΪ�Ҵ�������������B���ʵĻ����������ǻ���
��B��CΪ�Ҵ���ͭ����������������������������������Ӧ������ȩ����ѧ����ʽΪ2C2H5OH+O2![]() 2CH3CHO+2H2O��B+D�����������Ļ�ѧ����ʽΪCH3COOH + C2H5OH
2CH3CHO+2H2O��B+D�����������Ļ�ѧ����ʽΪCH3COOH + C2H5OH![]() CH3COOC2H5 + H2O��
CH3COOC2H5 + H2O��
(3)�ٸ���������������B��������ֱ�������ܻ������ܣ�װ��A����ȴˮ�½��ϳ������ˮ��Ϊa��
������A���ڲ�ṹ���볤ֱ������Ƚϣ������������Ӵ����������������Ч�����ã�
�����Ҵ������ʵ���Ϊ3xmol������������ʵ���Ϊ2xmol�����ݷ�ӦCH3COOH + C2H5OH![]() CH3COOC2H5 + H2O���Ҵ���������46��3x+60��2x=258�����x=1�����뷴Ӧ����������ʵ���Ϊ2mol���������������������������ʵ���Ϊ2mol�����ݲ���=
CH3COOC2H5 + H2O���Ҵ���������46��3x+60��2x=258�����x=1�����뷴Ӧ����������ʵ���Ϊ2mol���������������������������ʵ���Ϊ2mol�����ݲ���=![]() �������ɵ�����������ʵ������=2mol��88��50%=88g��
�������ɵ�����������ʵ������=2mol��88��50%=88g��


 һ����������ϵ�д�
һ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a mol Na2O2��b mol NaHCO3�����Ϻ����ܱ������м��ȵ�250����ʹ���ַ�Ӧ�����ų�����Ϊ��������ʱ��a�Ub������Ϊ
A. 3�U4 B. 3�U2 C. 2�U3 D. 4�U5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������AG��ʾ��Һ�����(acidity)��AG�Ķ���ΪAG=lg![]() �����б�����ȷ����
�����б�����ȷ����
A. 25 ��ʱ������Һ����������pH=7��AG=1
B. 25 ��ʱ������Һ����������pH<7��AG<0
C. 25 ��ʱ������Һ�ʼ�������pH>7��AG>0
D. 25 ��ʱ����Һ��pH��AG�Ļ��㹫ʽΪAG=2(7-pH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ͳ�Ļ��������������Ŵ������м����˺ܶѧ�о��ɹ������г�����ʫ�Ķ�Ӧ��ѧ֪ʶ��ȷ����![]()
ѡ�� | ��ʫ�� | ��ѧ֪ʶ |
A |
| ����������ˮ������Ϊˮ�������ȷ�Ӧ |
B |
| ��ǿˮ����ָ����� |
C |
| ����Ϊ���ĺϽ���Ӳ�ȱȴ����Ĵ��۵�ȴ����ĸ� |
D |
| ������ʯ��������������ɫ��Ӧ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʮ��������ѧ�����߶Ե��������̼�����������˹㷺������о���ȡ��һЩ��Ҫ�ɹ���
I����֪2NO��g��+O2��g�� ![]() 2NO2��g���ķ�Ӧ���̷�������
2NO2��g���ķ�Ӧ���̷�������
��һ����2NO��g�� ![]() N2O2��g�� ���죩 H1<0��v1��=k1��c2��NO�� ��v1��=k1��c��N2O2��
N2O2��g�� ���죩 H1<0��v1��=k1��c2��NO�� ��v1��=k1��c��N2O2��
�ڶ�����N2O2��g��+O2��g�� ![]() 2NO2��g�� ������ H2< 0�� v2��=k2��c��N2O2��c��O2����v2��=k2��c2��NO2��
2NO2��g�� ������ H2< 0�� v2��=k2��c��N2O2��c��O2����v2��=k2��c2��NO2��
��2NO��g��+O2��g�� ![]() 2NO2��g���ķ�Ӧ������Ҫ����______��������һ���������ڶ���������Ӧ������
2NO2��g���ķ�Ӧ������Ҫ����______��������һ���������ڶ���������Ӧ������
��һ���¶��£���Ӧ2NO��g��+O2��g�� ![]() 2NO2��g���ﵽƽ��״̬����д����k1����k1����k2����k2����ʾ��ƽ�ⳣ������ʽK=____________��
2NO2��g���ﵽƽ��״̬����д����k1����k1����k2����k2����ʾ��ƽ�ⳣ������ʽK=____________��
II������CO2��CH4�����������Ի�úϳ�������Ҫ�ɷ�ΪCO��H2�������ɼ�������������ŷţ�1����֪���������в��ַ�Ӧ���Ȼ�����ʽΪ��
�� CH4��g��=C��s��+2H2��g�� ��H>0
�� CO2��g��+H2��g��=CO��g��+H2O��g�� ��H>0
�� CO��g��+H2��g��=C��s��+H2O��g�� ��H<0
�̶�n��CO2��=n��CH4�����ı䷴Ӧ�¶ȣ�CO2��CH4��ƽ��ת���ʼ�ͼ�ס�
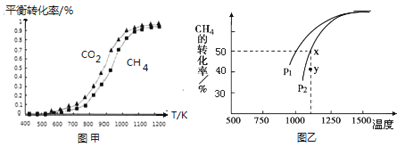
ͬ�¶���CO2��ƽ��ת����________��������������С����������������CH4��ƽ��ת���ʡ�
��2�����ܱ�������ͨ�����ʵ�����Ϊ0.1mol��CH4��CO2����һ�������·�����ӦCO2��g�� + CH4��g�� ![]() 2CO��g�� + 2H2��g����CH4��ƽ��ת�������¶ȼ�ѹǿ����λPa���Ĺ�ϵ��ͼ����ʾ��y�㣺v������_____v���棩��������������С��������������������֪�����ѹ��p����=������ѹ��p��������������ʵ�����������ƽ���ѹ����ƽ��Ũ�ȿ��Եõ�ƽ�ⳣ��Kp����x���Ӧ�¶��·�Ӧ��ƽ�ⳣ��Kp=__________________��
2CO��g�� + 2H2��g����CH4��ƽ��ת�������¶ȼ�ѹǿ����λPa���Ĺ�ϵ��ͼ����ʾ��y�㣺v������_____v���棩��������������С��������������������֪�����ѹ��p����=������ѹ��p��������������ʵ�����������ƽ���ѹ����ƽ��Ũ�ȿ��Եõ�ƽ�ⳣ��Kp����x���Ӧ�¶��·�Ӧ��ƽ�ⳣ��Kp=__________________��
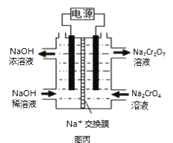
III������2CrO42��+2H+ ![]() Cr2O72��+H2O�����ͼ��װ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7��ͼ�����Ҳ�缫���ӵ�Դ��__��������Ʊ����̵��ܷ�Ӧ����ʽΪ__���ⶨ����Һ��Na��Cr�ĺ�������Na��Cr�����ʵ���֮��Ϊa��b�����ʱNa2CrO4��ת����Ϊ__����ѡ��������K2CO3�����ʵļ״���CH3OH��ȼ�ϵ�س䵱��Դ������ӦʽΪ__��
Cr2O72��+H2O�����ͼ��װ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7��ͼ�����Ҳ�缫���ӵ�Դ��__��������Ʊ����̵��ܷ�Ӧ����ʽΪ__���ⶨ����Һ��Na��Cr�ĺ�������Na��Cr�����ʵ���֮��Ϊa��b�����ʱNa2CrO4��ת����Ϊ__����ѡ��������K2CO3�����ʵļ״���CH3OH��ȼ�ϵ�س䵱��Դ������ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�����ʵ��̽��Ԫ�������ɺͻ�ѧ��Ӧ���ʡ�
(1)����ͬѧ������ͼװ��̽��ͬ���ں�ͬ����Ԫ�طǽ����Ե�ǿ����
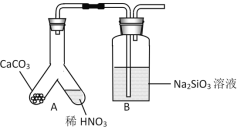
��A�з�Ӧ����Ϊ____����֤̼�ķǽ����Աȵ���___(����ǿ����������)��
��B�з�Ӧ����Ϊ____����֤̼�ķǽ����Աȹ��___(����ǿ����������)��
�۽��ۣ�ͬһ���ڴ�����Ԫ�طǽ�������____(������ǿ������������)�� ͬһ������ϵ���Ԫ�طǽ�������_______(������ǿ������������)��
��ijͬѧ���ǵ�ϡ����Ļӷ�����װ��A��B֮������һ��ʢ��_______�Լ���ϴ��ƿ��
(2)����ͬѧ�ں��������н���������ʵ�飬��ӦΪ��2HI(g)H2(g)+I2(g)��H2��I2����ʼŨ�Ⱦ�Ϊ0����Ӧ��HI��Ũ���淴Ӧʱ��ı仯������±���
ʵ����� | ʱ��/min Ũ��/molL��1 �¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 400 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
2 | 400 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
3 | 450 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
��ʵ��1�У���10��20 min�ڣ�v(HI)=__________molL��1min��l��
��0��20 min�ڣ�ʵ��2��ʵ��1�ķ�Ӧ����______(����������������)����ԭ�������_______________��
��ʵ��3��ʵ��2�ķ�Ӧ�ﵽƽ��ʱ��_________(����������������)����ԭ����_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�Ļ����м��壬������ҵ�о����ȵ㡣һ����ʯ�ͻ����з�������(��Ҫ�ɷ�ΪNiCO3��SiO2��������Fe2O3��Cr2O3)Ϊԭ���Ʊ��������Ĺ�ҵ������ͼ��
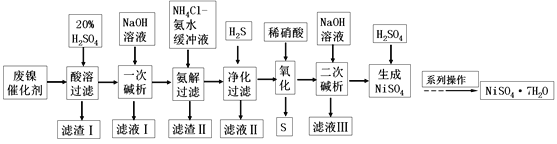
��֪����NiS��Ni(OH)2��Cr(OH)3��������ˮ��Cr(OH)3�������������
��Fe(OH)3������NH4Cl-��ˮ�Ļ��Һ��Ni(OH)2����NH4Cl-��ˮ�Ļ��Һ����[Ni(NH3)6]2+��
��ش��������⣺
(1)��������ʱΪ����߽�ȡ�ʣ��ɲ�ȡ�Ĵ�ʩ��________(��д��һ��)��
(2)������I������Ҫ�ɷ���_________��
(3)��һ�μ�����ʱ�������NaOH��Һ�����������������Ӧ�����ӷ���ʽΪ__________��
(4)����������Ŀ��Ϊ___����������ʱ�����H2S��Ŀ���ǽ���Ԫ��ת��Ϊ____������
(5)��������ʱ������Ӧ�����ӷ���Ϊ________��
(6)�����μ�����ʱ����ʹ��Һ�е�Ni2+������ȫ(����Ũ����10-5mol��L-1ʱ�����ӳ�����ȫ)������ά��c(OH-)������_______(��֪Ni(OH)2��Ksp=2��10-15��![]() ��1.4)��
��1.4)��
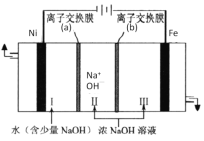
(7)��Fe��NiΪ�缫��ȡNa2FeO4��ԭ����ͼ��ʾ��ͨ��������缫���������Ϻ�ɫ��FeO42-�����ʱ�����ĵ缫��ӦʽΪ________�����ӽ���Ĥ(b)Ϊ__________(����������������)���ӽ���Ĥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���������������ԭ�����͵���(����)
A.����ɫ��NO2����ѹ����ɫ�ȱ�����dz
B.��ѹ�ȳ�ѹ�����ںϳ�SO3
C.��ҵ��ȡ������Na(l)��KCl(l) NaCl(l)��K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з������
D.������������ڰ��ĺϳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ݻ�Ϊ1L���ܱ������м���һ������X��Y��������ѧ��ӦaX(g)��2Y(s) ![]() bZ(g) ��H��0��ͼ��������X��Z�����ʵ���Ũ����ʱ��仯�����ߡ�����������Ϣ������˵����ȷ����
bZ(g) ��H��0��ͼ��������X��Z�����ʵ���Ũ����ʱ��仯�����ߡ�����������Ϣ������˵����ȷ����

A.������ͼ����÷���ʽ��a��b��1:3
B.�Ʋ��ڵ�7minʱ���߱仯��ԭ������Ǽ�ѹ
C.�Ʋ��ڵ�13minʱ���߱仯��ԭ�����������
D.��X��ʾ0~10min�ڸ÷�Ӧ��ƽ������Ϊv(X)��0.045mol/(L��min)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com