
【题目】若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )。
A. 1∶4 B. 1∶2
C. 2∶1 D. 4∶1
科目:高中化学 来源: 题型:
【题目】工业上用硫铁矿石(主要成分FeS2)在沸腾炉中焙烧,经过一系列反应,得到硫酸,焙烧后的矿渣用于炼铁。其转化过程如下图所示(部分条件、反应物和产物已略去):

请回答下列问题:
(1)在上面转化过程中,硫元素被氧化的反应是________(填反应编号)。
(2)写出反应②中炼铁的化学方程式_____________。若用1000t含杂质28%的矿渣炼铁,理论上可得到含铁96%的生铁质量为_____________ t.
(3)写出反应①的化学方程式 ,若有12.0g FeS2参加反应,则发生转移的电子数为 。
(4)烟气中SO2的排放会造成酸雨,工业上常用Na2SO3溶液来吸收SO2以减少对环境的危害。
①常温下,将SO2通入一定体积的1.0mol·L-1Na2SO3溶液中,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,此时溶液中c(SO32-)的浓度是0.2mol·L-1,则溶液中c(HSO3-)是 mol·L-1。用化学平衡原理解释此时溶液显酸性的原因 。
②向①中pH约为6时的吸收液中通入足量O2充分反应。取反应后溶液10mL与10mLBaCl2溶液混合,欲使混合时能生成沉淀,所用BaCl2溶液的浓度不得低于 mol·L-1。[已知25℃时,Ksp(BaSO3)=5.48×10-7, Ksp(BaSO4)= 1.08×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式可用H++OH-═H2O表示的是
A. 醋酸与KOH溶液反应
B. 稀硫酸与Ba(OH)2溶液反应
C. NaHSO4溶液与NaOH溶液反应
D. 盐酸与氨水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是
A.熔融状态下的NaHSO4电离:NaHSO4=Na++H++SO42-
B.H2CO3的电离:H2CO3![]() 2H++CO32-
2H++CO32-
C.Fe(OH)3的电离:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.水溶液中的NaHSO4电离:NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置。


(1)若利用甲实验,可通过观察__________________________现象,从而定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_____________________________,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:__________________________,若利用乙实验可进行定量分析,图中仪器A的名称为________________,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是_____________。
(2)将0.1 mol MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示,解释反应速率变化的原因:________________________________,H2O2初始物质的量浓度为__________(保留两位有效数字)。

(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5 g锌粒,通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸,10s时收集产生的H2的体积为44.8 mL(标准状况),用硫酸表示10 s内该反应的速率为________ mol·L-1·s-1(假设反应前后溶液的体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生如下反应:2M(g)+N(g) ![]() 2E(g)若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为
2E(g)若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为
A.20% B.40% C.60% D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离方法错误的是
A.采用蒸发法从食盐水中提取食盐
B.用结晶法除去硝酸钾中的氯化钠
C.用酒精从溴水中萃取溴
D.用分液法分离汽油和水的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存的是( )
A. Al3+、Na+、HCO3-、OH- B. Na+、Fe2+、H+、NO3-
C. K+、Fe3+、SCN-、SO32- D. Na+、Ag+、H+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)为第VIA元素.其单质和化合物在化工生产等方面具有重要应用。
(1)TeO2微溶于水,易溶于较浓的强酸和强碱。与盐酸反应时生成四氯化碲,其化学方程式为________________。
(2)25℃时;亚碲酸(H2TeO3)的 Ka1=1×10-3,Ka2=2×10-8。该温度下,0.1mol·L-1 H2TeO3的电离度α约为______________(α=![]() ×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
(3)工业上常用铜阳极泥(主要成分为Cn2Te,还含有少量的Ag、Au)为原料制备单质碲,其工艺流程如下:
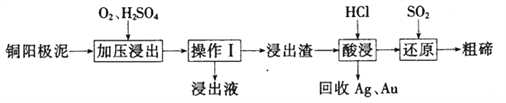
①实验室进行操作I时,下列仪器与该实验操作无关的为__________(填选项字母)。
A.长颈漏斗 B.烧杯 C.锥形瓶 D .玻璃棒
②已知‘浸出渣”的主要成分为TeO2。“加压浸出”时控制溶液pH为4.5~5.0,酸性不能过强的原因为_______________;“加压浸出”过程的离子方程式为______________________。
③“酸浸”后将SO2通入浸出液即可制得单质碲,则生成碲的化学方程式为________________。
④工业上还可以将铜阳极泥煅烧、碱浸后得到Na2TeO3,然后通过电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com