
【题目】碲(Te)为第VIA元素.其单质和化合物在化工生产等方面具有重要应用。
(1)TeO2微溶于水,易溶于较浓的强酸和强碱。与盐酸反应时生成四氯化碲,其化学方程式为________________。
(2)25℃时;亚碲酸(H2TeO3)的 Ka1=1×10-3,Ka2=2×10-8。该温度下,0.1mol·L-1 H2TeO3的电离度α约为______________(α=![]() ×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
(3)工业上常用铜阳极泥(主要成分为Cn2Te,还含有少量的Ag、Au)为原料制备单质碲,其工艺流程如下:
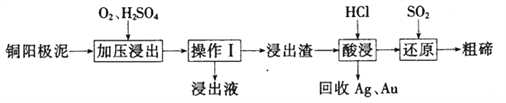
①实验室进行操作I时,下列仪器与该实验操作无关的为__________(填选项字母)。
A.长颈漏斗 B.烧杯 C.锥形瓶 D .玻璃棒
②已知‘浸出渣”的主要成分为TeO2。“加压浸出”时控制溶液pH为4.5~5.0,酸性不能过强的原因为_______________;“加压浸出”过程的离子方程式为______________________。
③“酸浸”后将SO2通入浸出液即可制得单质碲,则生成碲的化学方程式为________________。
④工业上还可以将铜阳极泥煅烧、碱浸后得到Na2TeO3,然后通过电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为___________。
【答案】TeO2 + 4HCl = TeCl4 + 2H2O10%<AC溶液酸性过强,TeO2会继续与酸反应导致碲元素损失Cu2Te+ 2O2+ 4H+ = 2Cu2+ + TeO2+ 2H2OTeCl4+2SO2+4H2O=Te↓+4HCl+2H2SO4TeO32-+ 3H2O+ 4e-=Te+ 6OH-
【解析】(1 )TeO2微溶于水,溶于盐酸时生成四氯化碲和水,发生反应的化学方程式为TeO2 + 4HCl = TeCl4 + 2H2O;
⑵亚碲酸(H2TeO3)为二元弱酸,其一级电离为主,H2TeO3的电离度为α,
H2TeO3![]() HTeO3-+H+
HTeO3-+H+
起始浓度(mol/L) 0.1 0 0
起始浓度(mol/L) 0.1α 0.1α 0.1α
起始浓度(mol/L) 0.1(1-α) 0.1α 0.1α
Ka1=1×10-3=![]() ,解得:α=10%;
,解得:α=10%;
已知Ka2=2×10-8,则HTeO3-的水解常数Kb=![]() =(1×10-14)÷(2×10-8)=0.5×10-6<Ka1,故HTeO3-的电离大于其水解,NaHTeO3溶液显酸性,pH<7;
=(1×10-14)÷(2×10-8)=0.5×10-6<Ka1,故HTeO3-的电离大于其水解,NaHTeO3溶液显酸性,pH<7;
(3)①操作I为过滤操作,所需要的仪器为漏斗、烧杯、玻璃棒,则下列仪器中长颈漏斗及锥形瓶与此操作无关,答案为AC;
②TeO2能溶解于较浓的强酸性或强碱性溶液,故“加压浸出”时控制溶液pH为4.5~5.0,的酸性不能过强,否则TeO2会继续与酸反应导致碲元素损失;“加压浸出”过程中用硫酸溶解Cu2Te的离子方程式为Cu2Te+ 2O2+ 4H+ = 2Cu2+ + TeO2+ 2H2O;
③用盐酸溶解TeO2后后溶液中存在TeCl4,将SO2通入浸出液即可制得单质碲,同时SO2发生氧化反应,得到硫酸,结合氧化还原反应中电子守恒规律,则生成碲的化学方程式为TeCl4+2SO2+4H2O=Te↓+4HCl+2H2SO4;
④用惰性电极电解Na2TeO3,阴极发生还原反应生成单质碲,其电极反应式为TeO32-+ 3H2O+ 4e-=Te+ 6OH-。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )。
A. 1∶4 B. 1∶2
C. 2∶1 D. 4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。目前降低尾气的可行方法是在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:(其中a、b、c均为正值)2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
(1)CO2的电子式为 。
(2)已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学反应方程式 。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
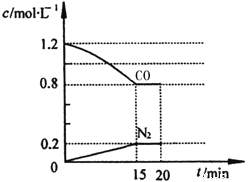
①有害气体NO的转化率为 ,0~15min NO的平均速率v(NO)= 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将 移动(选填“向左”、“向右”或“不”), 移动后在达到平衡时的平衡常数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中有着广泛的用途。
(1)基态铜原子的核外电子排布式为_____________。其晶体的堆积方式为__________________,
其中铜原子的配位数为_____________。
(2)向硫酸铜溶液中滴氨水,首先形成蓝色沉淀;继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液;继续向溶液中加入乙醇,会析出深蓝色晶体[Cu(NH3)4SO4·H2O]。
①氨水中各元素原子的电负性由大到小的顺序为_______________(用元素符号表示)。
②NH3中N原子的杂化轨道类型为_____________,与其互为等电子体的阳离子为__________。
③向蓝色沉淀中继续滴加氨水,沉淀溶解是因为生成了四氨合铜络离子,四氨合铜络离子的结构式
为____________;加入乙醇后析出晶体的原因为________________。
(3) CuCl2和CuCl是铜的两种常见的氯化物。
①下图表示的是________________ (填“CuCl2”或“CuCl”)的晶胞。
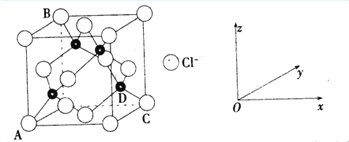
②原子坐标参数,表示晶胞内部各原子的相对位置,上图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为____________。
③上图晶胞中C、D两原子核间距为298 pm,阿伏伽德罗常数为NA,则该晶体密度为______g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol/L氨水的电离度为1.32%,下列有关叙述不正确的是
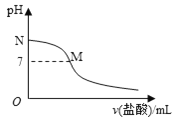
A.该滴定过程应该选择甲基橙作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D.N点处的溶液中pH<13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A.CO32-+H2O![]() HCO3-+OH-:用热的纯碱溶液清洗油污
HCO3-+OH-:用热的纯碱溶液清洗油污
B.A13++3H2O![]() AI(OH)3(胶体)+3H+:明矾净水
AI(OH)3(胶体)+3H+:明矾净水
C.SnCl2+H2O![]() Sn(OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
Sn(OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
D.TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+3H+:制备TiO2纳米粉
TiO2·xH2O↓+3H+:制备TiO2纳米粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将nmol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
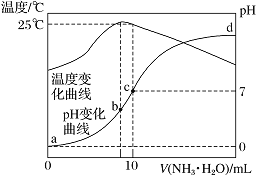
A. n=1.0
B. 水的电离程度:b>c>a>d
C. c点:c(NH)=c(Cl-)=1.0 mol·L-1
D. 25 ℃时,NH4Cl的水解常数(Kh)计算式为=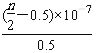
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com