
【题目】新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。目前降低尾气的可行方法是在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:(其中a、b、c均为正值)2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
(1)CO2的电子式为 。
(2)已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学反应方程式 。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
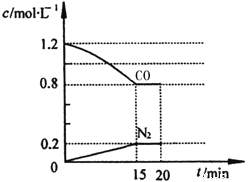
①有害气体NO的转化率为 ,0~15min NO的平均速率v(NO)= 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将 移动(选填“向左”、“向右”或“不”), 移动后在达到平衡时的平衡常数是 。
【答案】
(1)![]() (1分)
(1分)
(2)4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H="-a+b-2c" kJ·mol-1。 (2分)
N2(g)+4CO2(g) △H="-a+b-2c" kJ·mol-1。 (2分)
(3)①40% (1分) 0.027mol/(L·min) (1分) ②c d (2分)
③向左 (1分) 5/36L/mol或0.14 L/mol(2分)
【解析】
试题分析:(1)CO2的电子式 ![]() 。
。
(2)2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1 ①
N2(g)+2CO2(g) △H=-a kJ·mol-1 ①
2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1 ②
CO(g)+1/2O2(g)![]() CO2(g) △H=-c kJ·mol-1 ③
CO2(g) △H=-c kJ·mol-1 ③
由①-②+2×③得 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1。
N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1。
(3)①2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始浓度(mol·L-1) 1.2 1 0 0
转化浓度(mol·L-1) 0.4 0.4 0.2 0.4
平衡浓度(mol·L-1) 0.8 0.6 0.2 0.4
有害气体NO的转化率为![]() ×100%=40%;
×100%=40%;
0~15min NO的平均速率v(NO)= ![]() =0.027mol/(L·min)。
=0.027mol/(L·min)。
②a.缩小容器体积,CO浓度增大,所以错误。b.增加CO的量,CO浓度增大,所以错误。c.降低温度,正向移动,CO浓度减小,所以正确。d.扩大容器体积,CO浓度减小,所以正确。所以选c d。
③20min时再向容器中充入NO、N2各0.4mol,此时各成分的浓度变为
2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
瞬时浓度(mol·L-1) 0.8 0.6 0.4 0.6
Qc=![]() =0.625>0.14,所以逆向移动;化学平衡常数只和温度有关,温度不变,平衡常数不变,所以化学平衡常数还是
=0.625>0.14,所以逆向移动;化学平衡常数只和温度有关,温度不变,平衡常数不变,所以化学平衡常数还是![]() L/mol或0.14 L/mol。
L/mol或0.14 L/mol。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式可用H++OH-═H2O表示的是
A. 醋酸与KOH溶液反应
B. 稀硫酸与Ba(OH)2溶液反应
C. NaHSO4溶液与NaOH溶液反应
D. 盐酸与氨水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离方法错误的是
A.采用蒸发法从食盐水中提取食盐
B.用结晶法除去硝酸钾中的氯化钠
C.用酒精从溴水中萃取溴
D.用分液法分离汽油和水的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存的是( )
A. Al3+、Na+、HCO3-、OH- B. Na+、Fe2+、H+、NO3-
C. K+、Fe3+、SCN-、SO32- D. Na+、Ag+、H+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为 0.1 mol·L-1 的下列溶液: ①硫酸 ②醋酸 ③氢氧化钠
请回答下列问题:
(1)三种溶液中由水电离出的 H+浓度由大到小的顺序是(填序号)____________。
(2)已知 T ℃, KW=1×10-13,则 T ℃_________25 ℃(填“>”、 “<”或“=”)。在 T ℃时将pH=11的NaOH溶液a L与 pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则 a∶b=____________。
(3) 25 ℃时,有 pH=x 的盐酸和 pH=y 的氢氧化钠溶液(x≤6, y≥8),取 a L 该盐酸与 b L该氢氧化钠溶液反应,恰好完全中和,求:
①若 x+y=14,则 a/b=____________(填数据);
②若 x+y=13,则 a/b=____________(填数据);
③若 x+y>14,则 a/b=____________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的 pH 满足关系____________(用 x、 y 表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8 mL NO2和O2的混合气体通入倒立于水槽中装满水的量筒,充分反应后,剩余气体为1 mL,则原混合气体中NO2和O2的体积比可能为 ( )
A. 7∶5 B. 3∶7 C. 7∶1 D. 1∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)为第VIA元素.其单质和化合物在化工生产等方面具有重要应用。
(1)TeO2微溶于水,易溶于较浓的强酸和强碱。与盐酸反应时生成四氯化碲,其化学方程式为________________。
(2)25℃时;亚碲酸(H2TeO3)的 Ka1=1×10-3,Ka2=2×10-8。该温度下,0.1mol·L-1 H2TeO3的电离度α约为______________(α=![]() ×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
(3)工业上常用铜阳极泥(主要成分为Cn2Te,还含有少量的Ag、Au)为原料制备单质碲,其工艺流程如下:
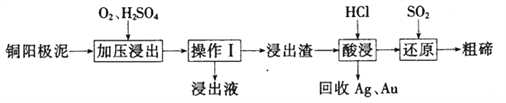
①实验室进行操作I时,下列仪器与该实验操作无关的为__________(填选项字母)。
A.长颈漏斗 B.烧杯 C.锥形瓶 D .玻璃棒
②已知‘浸出渣”的主要成分为TeO2。“加压浸出”时控制溶液pH为4.5~5.0,酸性不能过强的原因为_______________;“加压浸出”过程的离子方程式为______________________。
③“酸浸”后将SO2通入浸出液即可制得单质碲,则生成碲的化学方程式为________________。
④工业上还可以将铜阳极泥煅烧、碱浸后得到Na2TeO3,然后通过电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.活化分子间的碰撞一定发生化学反应
B.吸热反应只有加热才能发生
C.有能量变化的一定是化学反应
D.有化学键断裂不一定发生化学反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com