
【题目】现有浓度均为 0.1 mol·L-1 的下列溶液: ①硫酸 ②醋酸 ③氢氧化钠
请回答下列问题:
(1)三种溶液中由水电离出的 H+浓度由大到小的顺序是(填序号)____________。
(2)已知 T ℃, KW=1×10-13,则 T ℃_________25 ℃(填“>”、 “<”或“=”)。在 T ℃时将pH=11的NaOH溶液a L与 pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则 a∶b=____________。
(3) 25 ℃时,有 pH=x 的盐酸和 pH=y 的氢氧化钠溶液(x≤6, y≥8),取 a L 该盐酸与 b L该氢氧化钠溶液反应,恰好完全中和,求:
①若 x+y=14,则 a/b=____________(填数据);
②若 x+y=13,则 a/b=____________(填数据);
③若 x+y>14,则 a/b=____________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的 pH 满足关系____________(用 x、 y 表示)。
【答案】(1)②③① (2)>;101∶9
(3)①1 ②0.1 ③10x+y-14 ④x+y=14+![]()
【解析】
试题分析:(1)酸中电离出的氢离子或碱中电离出的氢氧根浓度越大,对水的电离抑制程度越大。硫酸是二元强酸,醋酸是一元强酸,氢氧化钠是一元强碱,因此这三种溶液中由水电离出的 H+浓度由大到小的顺序是②③①。
(2)已知 T ℃, KW=1×10-13>1×10-14,电离吸热,温度升高促进电离,所以 T ℃>25 ℃。在 T ℃时将pH=11的NaOH溶液a L与 pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,说明氢氧化钠过量,反应后溶液中氢氧根浓度是0.001mol/L,则![]() =0.001mol/L,解得 a∶b=101∶9。
=0.001mol/L,解得 a∶b=101∶9。
(3)25 ℃时,有 pH=x 的盐酸和 pH=y 的氢氧化钠溶液(x≤6, y≥8),取 a L 该盐酸与 b L该氢氧化钠溶液反应,恰好完全中和,则![]() ,解得
,解得![]() ,则
,则
①若 x+y=14,则 a/b=1;
②若 x+y=13,则 a/b=0.1;
③若 x+y>14,则![]() ;
;
④该盐酸与该氢氧化钠溶液完全中和,两溶液的 pH 满足关系即x+y=14+![]() 。
。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价见下表:
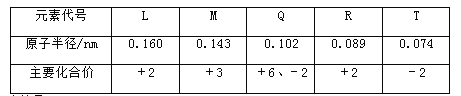
下列叙述正确的是( )
A. L、R的单质与稀盐酸反应速率L< R B. M与T形成的化合物有两性
C. Q、T两元素的氢化物分子间都存在氢键 D. L、Q形成的简单离子核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体
E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 。
(2)写出A、B所形成的化合物与E反应的化学方程式:
(3)A、B两元素形成的化合物属于 (“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A单质反应的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如下图所示的反应关系。下列物质组不满足上述转化关系的是( )

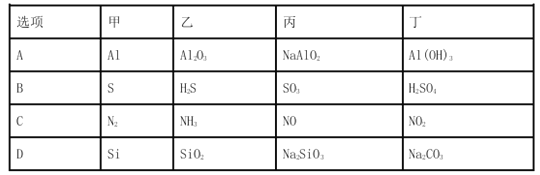
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周辉《清波杂志》卷十二:信州铅山胆水自山下注,势若瀑布,用以浸铜,铸冶是赖,虽干溢系夫旱涝,大抵盛于春夏,微于秋冬。古传一人至水滨,遗匙钥,翌日得之,已成铜矣。这里的胆水是指
A. FeSO4 溶液 B. CuSO4 溶液 C. 氨水 D. NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。目前降低尾气的可行方法是在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:(其中a、b、c均为正值)2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
(1)CO2的电子式为 。
(2)已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学反应方程式 。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
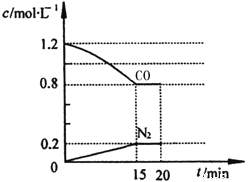
①有害气体NO的转化率为 ,0~15min NO的平均速率v(NO)= 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将 移动(选填“向左”、“向右”或“不”), 移动后在达到平衡时的平衡常数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2mol/L NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中有着广泛的用途。
(1)基态铜原子的核外电子排布式为_____________。其晶体的堆积方式为__________________,
其中铜原子的配位数为_____________。
(2)向硫酸铜溶液中滴氨水,首先形成蓝色沉淀;继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液;继续向溶液中加入乙醇,会析出深蓝色晶体[Cu(NH3)4SO4·H2O]。
①氨水中各元素原子的电负性由大到小的顺序为_______________(用元素符号表示)。
②NH3中N原子的杂化轨道类型为_____________,与其互为等电子体的阳离子为__________。
③向蓝色沉淀中继续滴加氨水,沉淀溶解是因为生成了四氨合铜络离子,四氨合铜络离子的结构式
为____________;加入乙醇后析出晶体的原因为________________。
(3) CuCl2和CuCl是铜的两种常见的氯化物。
①下图表示的是________________ (填“CuCl2”或“CuCl”)的晶胞。
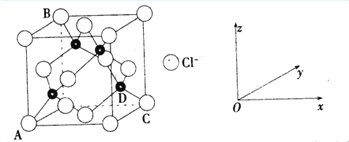
②原子坐标参数,表示晶胞内部各原子的相对位置,上图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为____________。
③上图晶胞中C、D两原子核间距为298 pm,阿伏伽德罗常数为NA,则该晶体密度为______g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A. 过滤时,漏斗的下端应紧贴烧杯内壁
B. 绐试管中的液体加热时,可以用手直接拿试管
C. 给试管中的固体加热时,试管口应略向上倾斜
D. 蒸馏液体时,冷水应从冷凝管的上端进入,下端出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com