
【题目】某温度下在密闭容器中发生如下反应:2M(g)+N(g) ![]() 2E(g)若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为
2E(g)若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为
A.20% B.40% C.60% D.80%
【答案】C
【解析】
试题分析:达平衡时,混合气体的压强比起始时增大了20%。根据压强之比等于物质的量之比,则有平衡时的物质的量比起始时增大了20%,即平衡后的总物质的量为2mol×(1+20%)=2.4mol。根据三段式可得:
2E(g)![]() 2M(g)+N(g)
2M(g)+N(g)
开始的物质的量 2 0 0
转化的物质的量 2x 2x x
平衡的物质的量 2-2x 2x x
即:(2-2x)+ 2x + x=2.4mol,解得x=0.4。则平衡时M的物质的量为0.8mol。因“2molM和1molN”与“2molE”互为等效平衡。则开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的物质的量也为0.8mol。即平衡时消耗M的物质的量为1.2mol,所以M的转化率为60%,答案选C。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
Ⅰ.配制100mL 0.10mol/L NaOH标准溶液.
Ⅱ.取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 20.00 | |
2 | 0.10 | 22.46 | 20.00 |
3 | 0.10 | 22.54 | 20.00 |
(1)第1次实验滴定前液面在0刻度,滴定后如图所示,则第一次实验滴定完用去NaOH溶液的体积记录为_________mL。滴定达到终点的现象是_____________________。
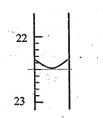
(2)根据上述数据,可计算出该盐酸的浓度为___________。
(3)在上述实验中,下列操作会造成测定结果偏高的有___________
A.滴定终点时俯视读数
B.酸式滴定管使用前,水洗后未用待测稀盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液,定容时仰视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中,加入400 mL 0.01 mol/L的Na2SO4溶液,针对此过程的下列叙述正确的是
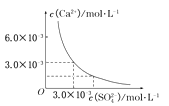
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其合金的说法不正确的是( )
A.目前我国流通的硬币是由合金材料制造的
B.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
C.出土的古代铜制品表面覆盖着铜绿其主要成分为 CuO
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )。
A. 1∶4 B. 1∶2
C. 2∶1 D. 4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸与二氧化锰反应制取氯气,下列有关说法中正确的是(气体体积在.标况下测定)( )
A. 若提供0.4 mol HCl,MnO2过量,则可制得氯气4.48 L
B. 若提供0.4 mol HCl,MnO2过量,则转移电子数一定为0.1mol
C. 若有0.4 mol HCl参加反应,则可制得氯气2.24 L
D. 若有0.4 mol HCl被氧化,则可制得氯气2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答有关氯气制备的几个问题
实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,该反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。现有两个同学分别设计的两套实验装罝如下图:
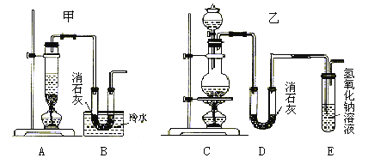
(1)写出制取氯气的离子方程式_______________________________。
(2)请从以下几个方面对甲乙两套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表格中。
a.不容易控制反应速率;b.容易控制反应速率;c.有副反应发生;d.可防止副反应发生;e.污染环境;f.可防止污染坏境。
优 点 | 缺点 | |
甲装罝 | ________ | ________ |
乙装罝 | ________ | ________ |
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,请从上述装罝中选取合理的部分,组装一套较完整的实验装罝,装置各部分连接顺序是(按气流流动的方向)__________。该组合中还缺少的装罝是_____________,原因是__________________________________。
(4)实验室若用16mol/L的盐酸l00mL与足量的二氧化锰反应,理论上最终生成的次氯酸钙的物质的量最多不超过__________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=﹣92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol/L氨水的电离度为1.32%,下列有关叙述不正确的是
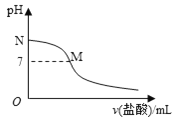
A.该滴定过程应该选择甲基橙作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D.N点处的溶液中pH<13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com