
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=﹣92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
【答案】C
【解析】
试题分析:A、容器①、②的反应温度相同,所以平衡常数相同,正确;B、将②中的0.2mol的氨气转化为氮气、氢气,再与原来的氮气、氢气的物质的量相加,也是1mol氮气、3mol氢气,与①完全相同,所以二者达到的平衡是等效平衡,氨气的体积发生相同,①中放出的热量是23.15kJ,说明生成氨气的物质的量是23.15kJ/92.6kJ/mol×2=0.5mol,消耗氮气的物质的量是0.25mol,剩余氮气的物质的量是1-0.25=0.75mol,则剩余氢气的物质的量是0.75mol×3=2.25mol,所以氨气的体积分数也是物质的量分数为0.5/(0.75+2.25+0.5)=1/7,正确;C、因为二者是等效平衡,所以容器②中达平衡时氨气的物质的量也是0.5mol,所以氮气需消耗0.15mol,则放出的热量是0.15mol×92.6kJ/mol=13.89kJ,错误;D、若容器①体积为0.5L,容器体积增大,压强减小,平衡逆向移动,所以放出的热量小于23.15kJ,正确,答案选C。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生如下反应:2M(g)+N(g) ![]() 2E(g)若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为
2E(g)若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为
A.20% B.40% C.60% D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如下图,其中只有M为金属元素。下列说法不正确的是( )
![]()
A. 原子半径Z < M
B. Y的最高价氧化物对应水化物的酸性比X 的弱
C. X 的最简单气态氢化物的热稳定性比Z的小
D. Z位于元素周期表中第二周期第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存的是( )
A. Al3+、Na+、HCO3-、OH- B. Na+、Fe2+、H+、NO3-
C. K+、Fe3+、SCN-、SO32- D. Na+、Ag+、H+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
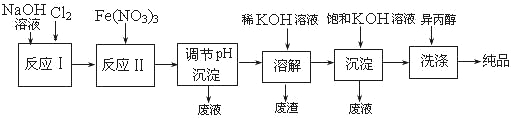
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应Ⅱ的离子方程式为 。
③高铁酸钾在水中技能消毒杀菌,又能净水,是一种理想的水处理剂,它能消毒杀菌是因为 ,它能净水的原因是因为 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液c(Fe3+)=4.0×10-5mol/L,则需要调整到 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子树脂M具有较好的吸水性,其合成路线如下:

已知: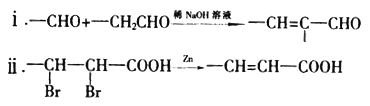
(1)C的名称为______________,D中的官能团为__________________,结构简式为_____________。
(2)由A生成B的化学方程式为___________________。
(3)上述合成路线中,D→E转化在合成M中的作用为___________________________。
(4)下列关于F的叙述正确的是___________。
A.能与NaHCO3反应生成CO2 B.能发生水解反应和消去反应
C.能聚合成高分子化合物 D. 1 mol G最多消耗2 mol NaOH
(5)H是G的同系物,且与G相差一个碳原子,则同时满足下列条件的H的同分异构体共有______种(不考虑立体异构)。
①与G具有相同的官能团 ②苯环上只有两个取代基
(6)根据上述合成路线和信息,以苯乙醛为原料(其他无机试剂任选),设计制备 的合成路线_________________________。
的合成路线_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是、
A. 在一定温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B. 在一定温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
C. 不同的气体,若体积不同,则它们所含的分子数—定不同
D. 气体摩尔体积是指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com