
【题目】下列说法中正确的是、
A. 在一定温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B. 在一定温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
C. 不同的气体,若体积不同,则它们所含的分子数—定不同
D. 气体摩尔体积是指1mol任何气体所占的体积约为22.4L
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=﹣92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol/L氨水的电离度为1.32%,下列有关叙述不正确的是
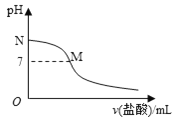
A.该滴定过程应该选择甲基橙作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D.N点处的溶液中pH<13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列物质的用途及解释均正确的是
选项 | 用途 | 解释 |
A | 可用FeCl3溶液刻蚀铜制电路板 | Fe3+的氧化性强于Cu2+ |
B | 碳与石英反应可冶炼粗硅 | 碳的非金属性比硅强 |
C | 四氯化碳可用于灭火 | 四氯化碳的沸点高 |
D | 酸性KMnO4溶 液可漂白织物 | KMnO4有强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线 a 和 b 是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是 ( )。
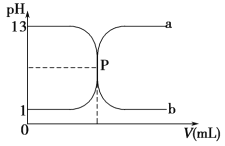
A.盐酸的物质的量浓度为 1 mol·L-1
B.P 点时恰好完全中和,溶液呈中性
C.曲线 a 是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物有广泛用途.工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下
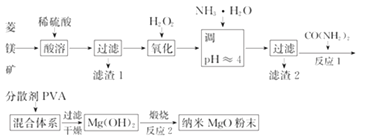
回答下列问题:
(1)滤渣1为____________(填化学式),CO(NH2)2的电子式为______。
(2)在实验室煅烧滤渣2制得的金属氧化物为______(填化学式),需要的仪器除酒精灯、三脚架以外,还需要______(填名称)。
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,反应的化学方程式为__________。
(4)室温时,加入CO(NH2)2,产生沉淀。当 Mg2+沉淀完全时,溶液中的c(OH-)=_______(离子浓度小于1.0×10-5molL-1时,即可认为该离子沉淀完全;室温时,Ksp[Mg(OH)2]=1.96×10-11)
(5)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制务纳米MgO。如图为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为__________。
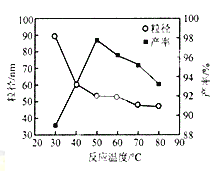
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质A经下列变化过程转化为D,其中C比B的相对分子质量多16,
![]()
已知D为强酸或者强碱,请回答下列问题:
(1)若常温下C为淡黄色固体,D的焰色为黄色,则工业制取D的反应方程式为:_______________;
(2)若A常温下是气体,C为红棕色气体。
①若A→B是工业制取硝酸的重要步骤之一,写出该步反应的化学方程式
为:_____________________________;
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的离子方程式
为:_________________________________________;
(3)若A为淡黄色固体,B是形成酸雨的罪魁祸首之一。
①D的化学式为:_________ ,
②酸雨放置在空气中一段时间其PH会变小后保持不变,请说明原因:
____________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届江苏省海安高级中学高三月考】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
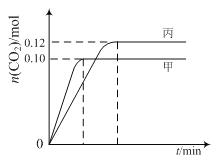
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A.该反应的正反应为吸热反应
B.达到平衡时,乙中CO2的体积分数比甲中的小
C.T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)>v(逆)
D.T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com