
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
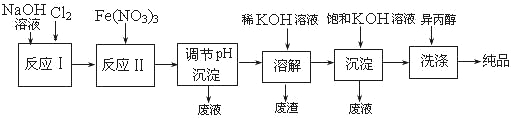
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应Ⅱ的离子方程式为 。
③高铁酸钾在水中技能消毒杀菌,又能净水,是一种理想的水处理剂,它能消毒杀菌是因为 ,它能净水的原因是因为 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液c(Fe3+)=4.0×10-5mol/L,则需要调整到 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
【答案】(10分)
(1)①减少高铁酸钾的溶解损失(1分)
②3ClO-+10OH-+3Fe2+=2FeO42-+3Cl-+5H2O (2分)
③高铁酸钾(K2FeO4)有强氧化性(1分)
高铁酸钾的还原产物水解产生的Fe(OH)3胶体有吸附性,使水澄清起净水作用(1分)
④3(2分)
(2)①增大K+浓度,促进K2FeO4晶体析出(1分) ②小 (1分)
(3)3:1 (2分)
【解析】
试题分析:(1)①为防止K2FeO4的溶解,可用异丙醇洗涤,所以答案是减少高铁酸钾的溶解损失。
②ClO-在碱性条件下可将Fe3+氧化为FeO42-,据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,反应II的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O。
③高铁酸钾(K2FeO4)在水中能消毒杀菌是因为有强氧化性,净水的原因是高铁酸钾的还原产物水解产生的Fe(OH)3胶体,有吸附性,使水澄清起净水作用。
④Ksp =c(Fe3+)·c3(OH-)= 4.0×10-38,所以=![]() ,c(OH-)=1.0×10-11,c(H+)=1.0×10-3,pH= 3;
,c(OH-)=1.0×10-11,c(H+)=1.0×10-3,pH= 3;
(2)①加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出;②溶解度小的沉淀先析出来,所以高铁酸钾的溶解度比高铁酸钠;
(3)干法制备K2FeO4的反应的方程式为:Fe2O3+3KNO3+4KOH![]() 2K2FeO4+3KNO2+2H2O,N元素化合价降低,是氧化剂,铁的化合价降低,是还原剂,氧化剂与还原剂的物质的量之比为3﹕1,
2K2FeO4+3KNO2+2H2O,N元素化合价降低,是氧化剂,铁的化合价降低,是还原剂,氧化剂与还原剂的物质的量之比为3﹕1,


科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的的恒容密闭容器中发生如下反应:PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | 达到平衡所需时(s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol/(L·s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸与二氧化锰反应制取氯气,下列有关说法中正确的是(气体体积在.标况下测定)( )
A. 若提供0.4 mol HCl,MnO2过量,则可制得氯气4.48 L
B. 若提供0.4 mol HCl,MnO2过量,则转移电子数一定为0.1mol
C. 若有0.4 mol HCl参加反应,则可制得氯气2.24 L
D. 若有0.4 mol HCl被氧化,则可制得氯气2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已达到电离平衡的0.1 mol/L的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH 降低,应采取的措施是
A.加热 B.加少量盐酸 C.加少量醋酸钠晶体 D.加少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=﹣92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质可用分液漏斗分离的正确组合是 ( )
①乙醇和乙酸 ②葡萄糖溶液和蔗糖溶液 ③苯和食盐水
④苯和苯酚 ⑤乙酸乙酯和乙醇 ⑥甲酸乙酯和饱和纯碱溶液
A. ③⑥ B. ①③④⑥ C. ①②④⑥ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲将蛋白质从水中析出而又不改变它的性质,应加入 ( )
A. (NH4)2SO4溶液 B. 75%的酒精溶液
C. CuSO4溶液 D. NaOH浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线 a 和 b 是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是 ( )。
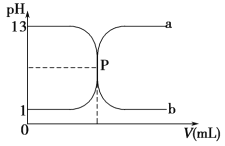
A.盐酸的物质的量浓度为 1 mol·L-1
B.P 点时恰好完全中和,溶液呈中性
C.曲线 a 是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com