
����Ŀ��һ���¶��£������������Ϊ2.0L�ĵĺ����ܱ������з������·�Ӧ��PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
��� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | �ﵽƽ������ʱ��s�� | |
PCl5��g�� | PCl3��g�� | Cl2��g�� | |||
�� | 320 | 0.40 | 0.10 | 0.10 | t1 |
�� | 320 | 0.80 | t2 | ||
�� | 410 | 0.40 | 0.15 | 0.15 | t3 |
����˵����ȷ����
A��ƽ�ⳣ��K��������>������
B����Ӧ����ƽ��ʱ��PCl5��ת���ʣ�������>������
C����Ӧ����ƽ��ʱ������I�е�ƽ������Ϊv(PCl5)=0.1/t1 mol/(L��s)
D����ʼʱ���������г���PCl5 0.30 mol��PCl3 0.45 mol��Cl2 0.10 mol����Ӧ�����淴Ӧ�������
���𰸡�D
��������
���������A��I��III��ȣ��ﵽƽ��ʱ������������ʵ�������˵�������¶ȣ�ƽ�������ƶ���������Ӧ�����ȷ�Ӧ���¶����ߣ�ƽ�ⳣ����������ƽ�ⳣ��K��������< ������A�����B��I��II���¶���ͬ��II����ʼŨ����I��2�����൱�ڸ�I��С���������С�����������ѹǿ����ƽ�������ƶ���PCl5��ת���ʽ��ͣ�����PCl5��ת���ʣ�������< ������B�����C����Ӧ����ƽ��ʱ������I�е�ƽ������Ϊv(PCl5)=v(PCl3)=0.10mol��(2L��t1 s)=0.05/t1 mol/(L��s)��C�����D�����ݱ������ݿɼ���III��ƽ�ⳣ��K=(0.075��0.075)��0.125=0.045�������������ʵ����ʵ����ɼ���Qc=(0.225 �� 0.05) �� 0.15=0.075>0.045�����Է�Ӧ������У�D����ȷ����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ԡ���ԭ�Ե�ǿ�������������ʵĽṹ�йأ��������ʵ�Ũ�Ⱥͷ�Ӧ�¶ȵ��йء����и������ʣ���Cu��HNO3��Һ����MnO2��������Һ����Zn��H2SO4��Һ����Fe��HCl��Һ������Ũ�Ȳ�ͬ���ܷ�����ͬ������ԭ��Ӧ����
A. �٢� B. �ۢ� C. �٢ڢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊ����ͭ��֮�����������˴��۶���ë������ɢ���̵����������ͭ�����о���ͭ������Cu��Sn�ȣ��ڳ�ʪ�����з����ĸ�ʴ�������ﱣ����������Ҫ���塣��ͼΪ��ͭ���ڳ�ʪ�����з����绯ѧ��ʴ��ԭ��ʾ��ͼ������˵������ȷ����
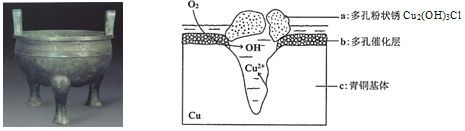
A. ��ͭ�������绯ѧ��ʴ��ͼ��c��������������
B. ���������ĵ缫��ӦΪO2+ 4e��+2H2O=4OH��
C. �����е�Cl�� ��������������Ӧ�IJ�����������a�����ӷ���ʽΪ2Cu2��+3OH��+Cl��=Cu2 (OH)3Cl��
D. ������0.2 mol Cu2(OH)3Cl�������������ĵ�O2���Ϊ4.48L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ����������г������Σ�����˵����ȷ����
A. �ӵ�ʳ���м�����ǵ⻯��
B. ҽҩ������ʳ��ˮ��Ũ����0.9%����ˮ�����������Һ����������ʵ���Ũ��ԼΪ0.155mol/L
C. ������������ʯī����������ⱥ��ʳ��ˮ�ɵ�����������
D. �����Ƽ���Ƶô����⣬���ɵ��Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC5H10O2�ҿ����������Ʒ�Ӧ���л��������У������������칹��
A. 4�� B. 8�� C. 13�� D. 15��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ��Ͷ�뵽ʢ������ij������������H2�����ʿ�����ͼ��ʾ�������������У��������Ũ�ȣ���þ���ı����������Һ���¶ȣ���Cl-��Ũ����Ӱ�췴Ӧ���ʵ�������
A�� �٢� B�� �ۢ� C�� �٢ڢ� D�� �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Һ���������ӵ�Ũ�����±�����M���ӿ���Ϊ
�������� | Cl�� | SO42�� | H+ | M |
Ũ��/��mol��L��1�� | 2 | 1 | 2 | 1 |
A��Na+
B��Ba2+
C��NO3��
D��Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������������У�δ�漰������ԭ��Ӧ����( )
A. ������� B. �ȼҵ C. ��ˮ���� D. ��ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ�������ȷ������Ź㷺����;��ʪ�����ɷ��Ʊ��������ε�ԭ�����±���ʾ��
ʪ�� | ǿ���Խ����У�Fe(NO3)3��NaClO��Ӧ�����Ϻ�ɫ����������Һ |
�ɷ� | Fe2O3��KNO3��KOH��ϼ��ȹ��������Ϻ�ɫ�������κ�KNO2�Ȳ��� |
(1)��ҵ����ʪ���Ʊ��������(K2FeO4)����������ͼ��ʾ��
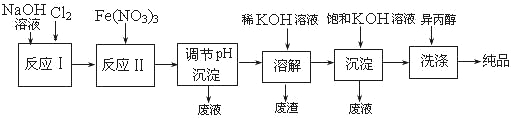
��ϴ�Ӵ�Ʒʱѡ�������������ˮ�������ǣ� ��
�ڷ�Ӧ������ӷ���ʽΪ ��
�۸��������ˮ�м�������ɱ�������ܾ�ˮ����һ�������ˮ����������������ɱ������Ϊ �����ܾ�ˮ��ԭ������Ϊ ��
����֪25��ʱFe(OH)3��Ksp = 4.0��10-38����ӦII�����Һc(Fe3+)=4.0��10-5mol/L,����Ҫ������ ʱ����ʼ����Fe(OH)3(��������Һ����ı仯)��
(2)������ͼ�ɼ���ʪ���Ʊ��������ʱ�������Ƶø������ƣ�Ȼ��������������м��뱥��KOH��Һ����������������ء�
�ټ��뱥��KOH��Һ��Ŀ���� ��
����������Ϣ��֪��������ص��ܽ�ȱȸ������� (���С��)��
(3)�ɷ��Ʊ�K2FeO4�ķ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com