
如图,将4mol SO2和2mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0。该反应达到平衡状态时,测得气体的总物质的量为4.2mol。试回答:
2SO3(g);ΔH<0。该反应达到平衡状态时,测得气体的总物质的量为4.2mol。试回答:
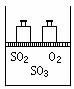 (1)在该平衡状态时n(SO3)=________________;
(1)在该平衡状态时n(SO3)=________________;
(2)若起始时加入1.2 mol SO2、0.6 mol O2和x mol SO3,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的取值为_________;
(3)若反应开始时的v(逆)>v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol。则起始时n(SO3)的取值范围是_____________。
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:阅读理解

| C(CH3OH)?C(H2O) |
| C(CO2)?C3(H2) |
| C(CH3OH)?C(H2O) |
| C(CO2)?C3(H2) |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2(t-BuNO).
2(t-BuNO).

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H
| 10 |
| 11 |
| ||
| 氢离子 |
| 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
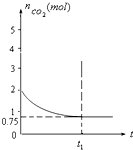 一定温度下,向1升的恒容容器中加入2moL碳和2moLCO2,反应为:
一定温度下,向1升的恒容容器中加入2moL碳和2moLCO2,反应为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com