
| A. | BaSO4难溶于水,所以BaSO4是非电解质 | |
| B. | 弱电解质的导电性一定比强电解质弱 | |
| C. | 25℃时0.1mol/L的CH3COOH溶液pH=3,说明CH3COOH为弱电解质 | |
| D. | 某物质能导电,所以该物质一定是电解质 |
分析 A、硫酸钡在熔融状态下能导电;
B、溶液的导电性取决于离子浓度;
C、25℃时0.1mol/L的CH3COOH溶液pH=3,溶液的氢离子浓度为10-3mol/L;
D、能导电的不一定是电解质.
解答 解:A、硫酸钡在熔融状态下能导电,故是电解质,故A错误;
B、溶液的导电性取决于离子浓度,和电解质的强弱无关,故B错误;
C、25℃时0.1mol/L的CH3COOH溶液pH=3,溶液的氢离子浓度为10-3mol/L,说明醋酸不能完全电离,故为弱电解质,故C正确;
D、物质有自由移动的电子或离子即能导电,而电解质必须是化合物,故能导电的不一定是电解质,故D错误.
故选C.
点评 本题考查了电解质、非电解质的判断和强弱电解质的区别,难度不大,应注意是强弱电解质的本质区别是电离程度.


科目:高中化学 来源: 题型:解答题
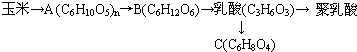
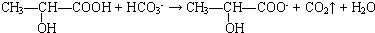
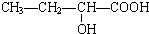 、
、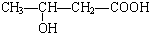 、
、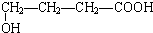
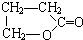 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
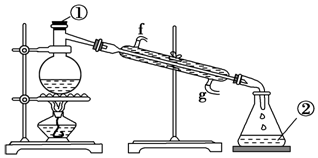
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 硅胶可做袋装食品的干燥剂 | |
| D. | 晶体硅可用于制作半导体材料与其熔点高硬度大无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
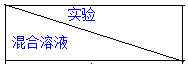 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
| 压强(kPa) | 200 | 500 | 1 000 |
| B的浓度(mol•L-1) | 0.04 | 0.1 | 0.27 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在河流入海口处易形成三角州 | |
| B. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| C. | 尿毒症患者做“血液透析” | |
| D. | 用石膏或盐卤点制豆腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1的纯碱溶液中含有0.1NA个Na+ | |
| B. | 常温常压下,23g NO2中含有NA个氧原子 | |
| C. | 常温常压下,22.4L CCl4含有个NACCl4分子 | |
| D. | 1molFe与足量的盐酸反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏符合节能减排的理念 | |
| B. | 自发反应也可能是熵减小的反应 | |
| C. | 二次电池放电过程中的反应属于自发反应 | |
| D. | 若C2H2的燃烧热为1300 kJ•mol-1,在其燃烧过程中每转移5NA个电子会放出1300 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com