
| A. | 在河流入海口处易形成三角州 | |
| B. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| C. | 尿毒症患者做“血液透析” | |
| D. | 用石膏或盐卤点制豆腐 |
分析 胶体是分散质介于1-100nm的分散系,胶体具有丁达尔效应,能够发生电泳,产生据此,胶体能够透过滤纸但是不能够通过半透膜,以此解答该题.
解答 解:A.江河中的泥浆属于胶体,江河入海口三角洲的形成是胶体聚沉的结果,故A不选;
B.FeCl3溶液中逐滴加入NaOH溶液,发生复分解反应生成氢氧化铁沉淀,与胶体性质无关,故B选;
C.血液中,蛋白质和血细胞颗粒较大,是胶体,不能透过透析膜,血液内的毒性物质直径较小,则可以透过,与胶体有关,故C不选;
D.用盐卤点豆腐是胶体的聚沉的应用,与胶体性质有关,故D不选.
故选B.
点评 本题考查胶体的性质,为高频考点,侧重于化学与生后的考查,有利于培养学生良好的科学素养,提高学生学习的积极性,明确胶体常见的性质有丁达尔现象、胶体的聚沉、电泳等以及利用胶体性质对生产生活中实际问题进行解释是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
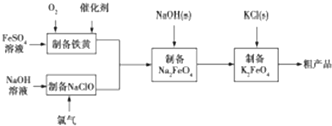
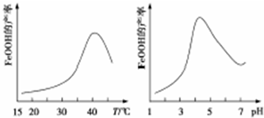
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4难溶于水,所以BaSO4是非电解质 | |
| B. | 弱电解质的导电性一定比强电解质弱 | |
| C. | 25℃时0.1mol/L的CH3COOH溶液pH=3,说明CH3COOH为弱电解质 | |
| D. | 某物质能导电,所以该物质一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 乙烯使溴水褪色 | |
| C. | 点燃乙烯出现黑烟 | |
| D. | 甲烷与氯气的混合气体,光照一段时间后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原氨水的浓度为10-3mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
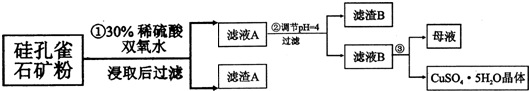
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com