
【题目】常温下,向1L0.1mol·L-1NH4Cl溶液中不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )

A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,![]() 不断增大
不断增大
D. 当n(NaOH)=0.05mo1时,溶液中有:c(Cl-)> c(NH4+)>c(Na+)>c(OH-)>c(H+)
【答案】C
【解析】
常温下,向1L0.1mol·L-1NH4Cl溶液中不断加入固体NaOH,则溶液中发生反应NH4++OH-=NH3H2O,随着反应进行,c(NH4+)不断减小,c(NH3H2O)不断增大。
A项、M点是向1L 0.1molL-1NH4Cl溶液中,不断加入NaOH固体后,反应得到氯化铵和一水合氨的混合溶液,溶液中铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离,此时水的电离程度小于原氯化铵溶液中水的电离程度,故A正确;
B项、根据电荷守恒c(H+)+c(NH4+)+c(Na+)=c(OH-)+c(Cl-),可得n(OH-)-n(H+)=[c(NH4+)+c(Na+)-c(Cl-)]×1L,在M点时c(NH4+)=0.05molL1,c(Na+)=amolL1,c(Cl-)=0.1molL1,带入数据可得n(OH-)-n(H+)=[0.05molL-1+a molL-1-0.1molL-1]×1L=(a-0.05)mol,故B正确;
C项、氨水的电离常数Kb=![]() ,则
,则![]() =
=![]() ,温度不变Kb不变,随着NaOH的加入,c(NH4+)不断减小,
,温度不变Kb不变,随着NaOH的加入,c(NH4+)不断减小,![]() 不断减小,则
不断减小,则![]() 不断减小,故C错误;
不断减小,故C错误;
D项、当n(NaOH)=0.05mol时,NH4Cl和NaOH反应后溶液中溶质为等物质的量的NH3H2O和NH4Cl、NaCl,NH3.H2O的电离程度大于NH4Cl水解程度,导致溶液呈碱性,钠离子、氯离子不水解,所以溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故D正确。
故选C。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】下列化学用语能正确表示相应意义的是( )
A. 乙烯的结构简式CH2CH2B. 丁烷的结构简式CH3(CH2)2CH3
C. 四氯化碳的电子式![]() D. 苯的分子式
D. 苯的分子式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CuS、Cu2S处理酸性废水中的Cr2O![]() ,发生反应如下:
,发生反应如下:
反应Ⅰ:CuS+Cr2O![]() +H+→Cu2++SO
+H+→Cu2++SO![]() +Cr3++H2O(未配平)
+Cr3++H2O(未配平)
反应Ⅱ:Cu2S+Cr2O![]() +H+→Cu2++SO
+H+→Cu2++SO![]() +Cr3++H2O(未配平)
+Cr3++H2O(未配平)
下列有关说法正确的是( )
A.反应Ⅰ和Ⅱ中Cu2+、SO![]() 都是氧化产物
都是氧化产物
B.处理1molCr2O![]() 时反应Ⅰ、Ⅱ中消耗H+的物质的量相等
时反应Ⅰ、Ⅱ中消耗H+的物质的量相等
C.反应Ⅱ中还原剂、氧化剂的物质的量之比为3:5
D.反应Ⅰ、Ⅱ中每处理1molCr2O![]() ,转移电子数不相等
,转移电子数不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验,请回答下列问题:
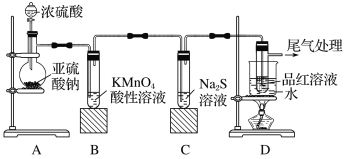
(1)装置A中盛放亚硫酸钠的仪器名称是__。
(2)实验过程中,装置B中发生的现象是__,说明SO2具有的性质是__。
(3)装置B中发生反应的离子方程式为__。
(4)尾气可采用__溶液吸收,离子方程式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,不正确的是

A.过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+
B.过程②中,Fe3+作氧化剂
C.回收S的总反应为2H2S+O2=2H2O+2S↓
D.过程③中,各元素化合价均未改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在固定容积的密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中气体的压强不再发生变化
④单位时间内生成n mol Z,同时生成n mol X
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物瑞德西韦(Remdesivir)对新冠病毒有明显抑制作用,化合物 M是合成瑞德西韦的中间体,下列关于M的说法错误的是
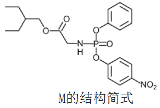
A.核磁共振氢谱共有11个吸收峰
B.分子中含有3种含氧官能团
C.分子中N原子一个是sp2杂化,一个是sp3杂化
D.1mol该物质与足量NaOH溶液反应时消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
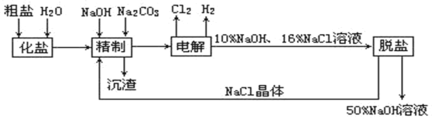
依据上图,完成下列填空:
(1)用惰性电极电解饱和食盐水时,与电源正极相连的电极上所发生的电极反应式为_____________;与电源负极相连的电极附近,溶液pH______(选填:不变、升高或下降)。
(2)如果粗盐中SO42-含量较高,必须加钡剂除去,该钡试剂可以是_________;
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_______________、_______________;
(4)氯碱工业所用的隔膜电解装置,广泛应用于多种化工产品生产,如工业上用惰性电极电解Na2CO3溶液得到含NaHCO3,原理如下图所示。
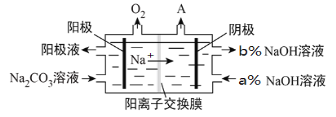
阴极产生的物质A的化学式为__________,a%_____b%(填“<、>、=”),NaHCO3产生在_______室(填“阴极”或“阳极”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下三个热化学方程式:
H2(g)+1/2O2(g)== H2O(g) ΔH=a kJ·mol-1
H2(g)+1/2O2(g)== H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)== 2H2O(l) ΔH=c kJ·mol-1
关于它们的下列表述正确的是( )
A.2b=cB.a、b和c均为正值C.a=bD.它们都是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com