
以下说法中正确的是( )
A.△H<0的反应均是自发反应
B.自发进行的反应一定能迅速进行
C.冰在室温下自动熔化成水,是熵增的重要结果
D.高锰酸钾加热分解是一个熵减小的过程
C
【解析】
试题分析:A.△H<0的反应均是自发反应,不一定,如碳的燃烧,所以是放热反应,但是常温下还是不自发的,需要加热后才是自发反应。
B.自发进行的反应一定能迅速进行 ,不一定,反应自发与否和反应的快慢没有直接的联络。
C.冰在室温下自动熔化成水,是熵增的重要结果 ,正确。
D.高锰酸钾加热分解是一个熵减小的过程 ,是熵增大的过程;故选C 。
考点:自发反应 熵
点评:对于反应的自发性判断依据是△G=△H-T△S △G——吉布斯自由能。
△H——焓变(△H<0为放热反应,△H>0为吸热反应)。
△S——熵(物质混乱度的量度,如固体变成气体,混乱度增加,△S>0)。
T——温度 判断反应能否自发进行用吉布斯自由能判据。
如果△G<0 反应可以自发进行;反之则不可以自发进行。
恒温恒压下:
当△H<0,△S>0时,反应自发进行;
当△H>0,△S<0时,反应不自发进行;
当△H>0,△S>0或△H<0,△S<0时,反应是否自发与温度有关,
一般低温时焓变影响为主;高温时,熵变影响为主,而温度影响的。
大小要看△H和△S的具体数值而定。
反应总是在一定条件下进行的。要讨论反应的自发性,也要指明反应条件。如果没有交代反应条件,只讲“某某反应不自发”“某某反应自发”,实际上是指在常温常压下进行的反应。“一定条件”指“一定的温度一定压强”。例如,反应 CaCO3=" CaO" + CO2↑ 在常温常压是非自发的,而在高温下则是自发发生的。 用吉布提自由能计算公式(△G=△H-T△S)来判断反应能否自发进行时,可以看到T对△G的值有影响,在某些情况下,可能决定△G是大于0还是小于0;式中△H 是一个与温度、压强有关的物理量。因此,讨论△G是大于0还是小于0,实际上也是在一定温度与压强下进行的。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (2011?济宁高一检测)化学电池在通讯、交通及日常生活中有着广泛的应用.
(2011?济宁高一检测)化学电池在通讯、交通及日常生活中有着广泛的应用.| 放电 | 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 有些化学反应的化学能能直接转化成电能
有些化学反应的化学能能直接转化成电能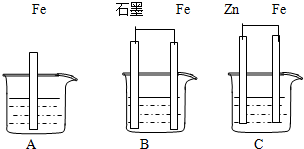
| 放电 | 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
2- 4 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com