
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
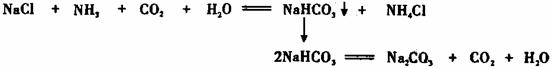
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
⑴ 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
 ①乙装置中的试剂是 ;
①乙装置中的试剂是 ;
②丁装置中稀硫酸的作用是 ;
⑵ 另一位同学用图中戊装置(其它装置未画出)进行实验。
实验时,须先从 管通入 气体,再从 管中通入 气体;
②有同学建议在戊装置的b管下端连接己装置,理由是 ;
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
下列实验能达到目的的是
A.用锌与稀硝酸制备H2 B.CaCO3中混有少量NaHCO3,可用加热的方法除去
C.可用蒸馏水来区分NO2和溴蒸气 D.用相互滴加的方法来鉴别AlCl3和氨水两瓶试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法正确的是 ( )
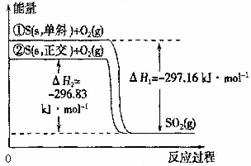
A.S(s,单斜) = S(s,正交) △H = + 0.33 kJ·mol-1
B.相同物质的量的正交硫比单斜硫所含有的能量高
C.正交硫比单斜硫稳定
D.①表示断裂1mol O2中的共价键所吸收的能量比形成l mol SO2中的共价键所放出的能量少297.16 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是 ( )
| 选项 | 实验目的 | 玻璃仪器 |
| A | 分离乙醇和乙酸乙酯的混合物 | 分液漏斗、烧杯 |
| B | 用pH=1的盐酸配制100 mL pH=2的盐酸 | 100 mL容量瓶、烧杯、玻璃棒、胶头滴管 |
| C | 用溴水、淀粉KI溶液比较Br2与I2的氧化性强弱 | 试管、胶头滴管 |
| D | 用NH4Cl固体和Ca(OH)2固体制备并收集NH3 | 酒精灯、烧杯、导管、集气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
无色溶液可能由K2CO3、MgCl2、NaHCO3、BaCl2溶液中的一种或几种组成。向溶液中加入烧碱溶液出现白色沉淀,加入稀硫酸也出现白色沉淀并放出气体。据此分析,下列判断中正确的是( )
①肯定有BaCl2 ②肯定有MgCl2 ③肯定有NaHCO3
④肯定有Na2CO3或NaHCO3 ⑤肯定没有MgCl2
A.①②③ B.②④ C.①③ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,一定能大量共存的是
A.Fe3+、Na+、SO42-、H2O2 B.C2H5OH、MnO4-、H+ 、K+
C.Pb2+、K+ 、SO42-、Cl- D.Na+、SO32- 、CH3COO-、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。由此可推测BeCl2
A.熔融不导电 B.水溶液呈中性
C.熔点比BeBr2高 D.不与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)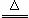 Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置D的作用是 。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 。已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是 。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有 。
a .烧杯 b .蒸发皿 c.试管 d .锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:
已知Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com