
工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)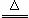 Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置D的作用是 。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 。已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是 。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有 。
a .烧杯 b .蒸发皿 c.试管 d .锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:
已知Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
科目:高中化学 来源: 题型:
在一个体积为2L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)⇌FeO(s)+CO(g).其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示.
(1)反应在1min时第一次达到平衡状态,固体的质量增加了3.2g.用CO2的浓度变化表示的反应速率v(CO2)= 0.1mol•L﹣1•min﹣1 .
(2)反应进行至2min时,若只改变温度,曲线发生的变化如图所示,3min时再次达到平衡,则△H > 0(填“>”、“<”或“=”).
(3)5min时再充入一定量的CO(g),平衡发生移动.下列说法正确的是 c (填写编号).
a.v正先增大后减小 b.v正先减小后增大
c.v逆先增大后减小 d.v逆先减小后增大
表示n(CO2)变化的曲线是 b (填写图中曲线的字母编号).
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态: 固体总质量保持不变 .
查看答案和解析>>
科目:高中化学 来源: 题型:
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
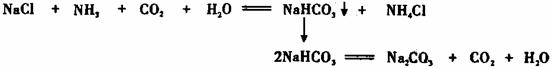
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
⑴ 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
 ①乙装置中的试剂是 ;
①乙装置中的试剂是 ;
②丁装置中稀硫酸的作用是 ;
⑵ 另一位同学用图中戊装置(其它装置未画出)进行实验。
实验时,须先从 管通入 气体,再从 管中通入 气体;
②有同学建议在戊装置的b管下端连接己装置,理由是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
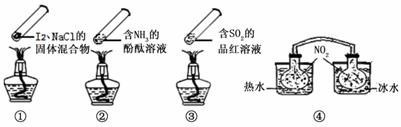
A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B.加热时,②、③中的溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中都有可逆反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5
mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是
A.反应后溶液中Fe3+物质的量为0.8 mol
B.反应后产生13.44 L H2(标准状况)
C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol
D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是 ( )
A.在任何条件下,1mol任何气体的体积都约是22.4L
B.化学的特征就是认识分子和制造分子
C.在化学反应中,反应物的物质的量之和一定等于生成物的物质的量之和。
D.英国科学家道尔顿提出元素周期律,把化学元素及其化合物纳入一个统一的理论体系。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.NaHCO3的电离方程式为:NaHCO3=Na++H++CO32-
B.金属氧化物不一定是碱性氧化物
C.在碱性溶液中能大量共存的离子为:Fe3+、Na+、Cl-、SO42-
D.SO3溶于水,其水溶液能导电,SO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是元素周期表的一部分,下列关系正确的是
A.还原性:Se2->S2->C1- B. 热稳定性:HC1>H2Se>HBr
C.原子半径:Se>C1>S D. 酸性:HBrO4>HClO4>H2SO4
| S | Cl |
| Se | Br |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(1)Zn(s)+1/2O2(g) = ZnO(s)△H =-348.3 kJ/mol
(2)2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H等于( )
A.-317.3 kJ/mol B.-379.3 kJ/mol C.-332.8 kJ/mol D.+317.3 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com