
【题目】在常温下,用0.100 0 mol·L-1的盐酸滴定25 mL 0.100 0 mol·L-1 Na2CO3溶液,所得滴定曲线如下图所示。下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
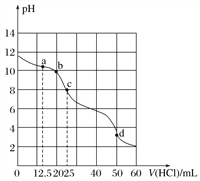
A. a点:c(HCO![]() )>c(Cl-)>c(CO
)>c(Cl-)>c(CO![]() )
)
B. b点:c(Na+)+c(H+)=c(Cl-)+c(HCO![]() )+c(CO
)+c(CO![]() )+c(OH-)
)+c(OH-)
C. c点:c(OH-)+c(CO![]() )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)
D. d点:c(Cl-)=c(Na+)
【答案】B
【解析】A.a点n(HCl)=0.1000mol/L×0.0125L=0.00125mol,n(Na2CO3)=0.1000mol/L×0.025L=0.0025mol,反应生成0.00125molNaCl和NaHCO3,剩余0.00125molNa2CO3,碳酸根离子水解程度大于碳酸氢根离子,所以c(CO32-)<c(HCO3-),根据物料守恒可知:c(HCO3-)>c(Cl-)>c(C032-),故A正确;B.b点时根据电荷守恒可知:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+2c(CO32-)+c(OH-),故B错误;C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,根据质子守恒得c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故C正确;D.d点n(HCl)=0.1000mol/L×0.050L=0.005mol,为碳酸钠物质的量的二倍,二者反应方程式为 Na2CO3+2HCl=2NaCl+CO2+H2O,溶液中的溶质为NaCl,根据物料守恒得c(Na+)=c(Cl-),故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料 MnO2(反应条件已省略)。
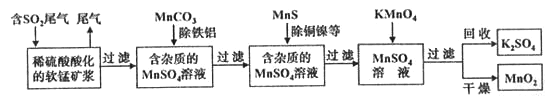
请回答下列问题:
(1)上述流程脱硫实现了____________(选填下列字母编号)。
a.废弃物的综合利用 b.白色污染的减少 c.酸雨的减少
(2)KMnO4+MnSO4→MnO2的反应中,氧化剂与还原剂的物质的量之比为____________。
(3)已知:25℃、101kPa 时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)= MnSO4(s) △H=-1065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式为:_______________________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2其阳极的电极反应式是__________________________________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式为:____________________________________________________。若以该电池为电源,以石墨作电极电解CuSO4溶液,阴极析出铜,阳极产物是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,《本草纲目》中有如下记载:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中利用KNO3的性质是( )
A. 自燃性 B. 稳定性 C. 还原性 D. 氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、4 mol·L-1硫酸溶液,其他试剂任选。填写下列空白:
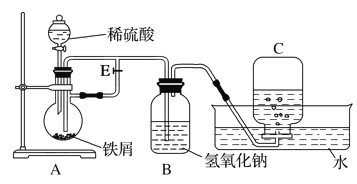
(1)实验开始时应先将活塞E________(填“打开”或“关闭”)。
(2)在该实验中生成的Fe(OH)2白色沉淀可保持较长时间,可能的原因为_______________________________。
(3)拔去装置B中的橡皮塞,使空气进入,写出Fe(OH)2被氧化的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素/H2O2溶液可用于烟气的脱硫脱硝。
(1)已知T℃时,2SO2(g)+O2(g) ![]() 2SO3(g) △H1
2SO3(g) △H1
2H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=__________ (用含△H1、△H2、△H3的代数式表示)
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为______________;NO和NO2以物质的量之比1:1与CO(NH2)2反应生成无毒气体的化学方程式为_______________。
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
温度/K | 338 | 343 | 348 | 353 |
平衡时气体的总浓度/mol L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
该反应的△H__________(填“>”或“<”)0;348K时,该反应的平衡常数K__________________。
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图所示。

①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为____________。
(2)脱硝时,最佳pH为_________;在碱性较强时,NOx脱除率降低,其原因是___________(任写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 将pH均为a的NaOH溶液和氨水分别加水稀释100倍,pH分别变为b和c,则a、b、c的大小关系为b>c>a
B. 常温下0.1 molL-1 KHA溶液的pH=3,则该溶液中C(A2- )<c(H2A)
C. 室温时 M(OH)2(s)![]() M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b molL-1 时,溶液的pH为14 +
M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b molL-1 时,溶液的pH为14 +![]() 1g
1g![]()
D. 0.1 molL-1 Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠广泛用于工业、建筑业及食品加工业。某课外活动小组的同学拟制备亚硝酸钠、侧定其产品的纯度并验证亚硝酸钠的某些性质。
(1)甲组同学采用下图装置制取亚硝酸钠。
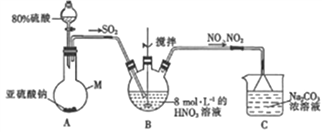
①仪器M的名称是______。
②装置A中用较浓的硫酸而不用稀硫酸的原因是________。
③若装置B中生成等物质的量的NO与NO2,则装置B中发生反应的离子方程式为_________。
④已知NO与NaOH溶液不反应,而NO2可与NaOH溶液发生反应:2NO2+2NaOH==NaNO3+NaNO2+H2O。若通入装置C中的NO与NO2物质的量之比为1:1,则装置C中发生的化学方程为_______。
(2)乙组同学拟测定甲组制得的产品中NaNO2的纯度。乙组同学采用高锰酸钾滴定法:称取mg试样于锥形瓶中,加入适量水溶解,然后用cmol/L的KMnO4溶液(适量稀H2SO4酸化)进行测定,并重复上述操作2次。
①高锰酸钾溶液应盛放在______(填“酸式”或“碱式”)测定管中。
②滴定至终点时溶液颜色变化是______。
③若滴定终点时平均消耗VmL标准溶液,则产品的纯度为____(用含c、m、V的代数式表示)。
(3)丙组同学拟设计实验证明:
①酸性条件下NaNO2具有氧化性,实验操作为________。
②HNO3的酸性比CH3COOH强,实验操作为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于取代反应的是
A. 甲苯使酸性高锰酸钾溶液褪色 B. 乙烯与溴的四氯化碳溶液反应
C. 苯与浓硝酸和浓硫酸的混合液加热反应 D. 在苯中滴入溴水,溴水层变为无色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com