
【题目】尿素/H2O2溶液可用于烟气的脱硫脱硝。
(1)已知T℃时,2SO2(g)+O2(g) ![]() 2SO3(g) △H1
2SO3(g) △H1
2H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=__________ (用含△H1、△H2、△H3的代数式表示)
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为______________;NO和NO2以物质的量之比1:1与CO(NH2)2反应生成无毒气体的化学方程式为_______________。
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
温度/K | 338 | 343 | 348 | 353 |
平衡时气体的总浓度/mol L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
该反应的△H__________(填“>”或“<”)0;348K时,该反应的平衡常数K__________________。
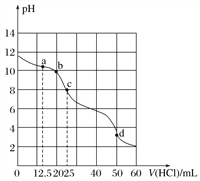
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图所示。

①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为____________。
(2)脱硝时,最佳pH为_________;在碱性较强时,NOx脱除率降低,其原因是___________(任写一点)。
【答案】 ![]() ΔH1+
ΔH1+![]() ΔH2+ΔH3 (NH4)2SO4 NO+NO2+CO(NH2)2=2N2+CO2+2H2O > 0.032 1:2 7 H2O2氧化性减弱(或其他合理答案)
ΔH2+ΔH3 (NH4)2SO4 NO+NO2+CO(NH2)2=2N2+CO2+2H2O > 0.032 1:2 7 H2O2氧化性减弱(或其他合理答案)
【解析】(1). 反应SO2(g)+H2O2(I))=H2SO4(I)可由①2SO2(g)+O2(g) ![]() 2SO3(g)②2H2O2(I)=2H2O(I)+O2(g)③SO3(g)+H2O(I))=H2SO4(I)经如下处理①
2SO3(g)②2H2O2(I)=2H2O(I)+O2(g)③SO3(g)+H2O(I))=H2SO4(I)经如下处理①![]() +②
+②![]() +③得到,所以 △H4=
+③得到,所以 △H4= ![]() ΔH1+
ΔH1+![]() ΔH2+ΔH3
ΔH2+ΔH3
(2). ①烟气中SO2通入氧气的体积分数为7%、尿素浓度为5%的反应器中,二氧化硫可以被氧气氧化为硫酸,硫酸可以催化尿素(分子中含酰胺键)发生水解,并与尿素的水解产物氨反应生成硫酸铵,所以最终转化的正盐化学式为(NH4)2SO4 ;NO和NO2以物质的量之比1:1与CO(NH2)2反应生成无毒气体,根据NO中N元素的化合价为+2,NO2中N元素的化合价为+4,而中N元素化合价为-3、C元素的化合价为+4,三种价态的N元素发生归中反应右生成氮气,+4价的C可以转化为CO2,所以此无毒气体是氮气和二氧化碳,化学方程式为NO+NO2+CO(NH2)2=2N2+CO2+2H2O。②将一定量的氨基甲酸铵置于恒容密闭容器中发生反应,根据表中数据可知,平衡时气体的总浓度随温度的升高而增大,所以升高温度后,化学平衡向正反应反应方向移动,因此,正反应为吸热反应,△H>0。348K时,平衡气体的总浓度为0.60/mol L-1, 由NH2COONH4(s)![]() 2NH3(g)+CO2(g)可求出c(NH3)=0.40 mol L-1、c(CO2)=0.20 mol L-1, 代入该反应的平衡常数表达式K= c2(NH3)
2NH3(g)+CO2(g)可求出c(NH3)=0.40 mol L-1、c(CO2)=0.20 mol L-1, 代入该反应的平衡常数表达式K= c2(NH3) ![]() c(CO2)= 0.032。
c(CO2)= 0.032。
(3). ①NO与H2O2发生反应生成亚硝酸时,双氧水是氧化剂,一氧化氮是还原剂,化学方程式为2NO+H2O2=2HNO2,所以氧化剂与还原剂的物质的量之比为1:2。
(2)由图中信息可知:pH=7时,氮氧化物脱除率最高,所以脱硝时,最佳pH为7;在碱性较强时,NOx脱除率降低,其原因是H2O2氧化性随溶液碱性增强而减弱。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24 L H2中所含质子数、中子数均为2NA
B. 71g 氯气与足量铁粉充分反应,转移的电子数为3NA
C. IL 1 mol·L-1的盐酸中所含粒子总数为2NA
D. 同质量、不同密度的N2和CO 中的原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下n为气体。m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是

A. 原子半径:Z>Y
B. 图示转化关系涉及的反应均为氧化还原反应
C. 最简单气态氢化物的稳定性:W>X
D. 化合物p中只存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1molCH4与Cl2发生光照下反应,生成相同物质的量的4种取代物,则消耗的Cl2的物质的量为
A.0.5 molB.2 molC.2.5 molD.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,用0.100 0 mol·L-1的盐酸滴定25 mL 0.100 0 mol·L-1 Na2CO3溶液,所得滴定曲线如下图所示。下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
A. a点:c(HCO![]() )>c(Cl-)>c(CO
)>c(Cl-)>c(CO![]() )
)
B. b点:c(Na+)+c(H+)=c(Cl-)+c(HCO![]() )+c(CO
)+c(CO![]() )+c(OH-)
)+c(OH-)
C. c点:c(OH-)+c(CO![]() )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)
D. d点:c(Cl-)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应 3S+6KOH=K2SO3+2K2S+3H2O中,还原剂和氧化剂的物质的量为: ( )
A. 1 :1 B. 2 :1 C. 1 :2 D. 3 :2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校购买的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为1.84mol/L
B. 1mol Zn与足量的该硫酸反应产生2gH2
C. 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的是( )
①FeCl3溶液:K+、Na+、SO42﹣、AlO2﹣
②使紫色石蕊试液变红的溶液:Na+、Fe2+、NO3﹣、SO42﹣
③向存在大量MnO4-的溶液中:NH4+、Fe3+、SO42﹣、C2H5OH
④在强酸性溶液中:K+、Fe2+、SO42﹣、Br﹣
⑤在pH=1的无色溶液中,CrO42—、K+、Na+、SO42—
⑥在中性溶液中:K+、Fe3+、SO42﹣、Br﹣
⑦在水电离产生的c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
A. ①④ B. ③⑥ C. ①⑤ D. ④⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com