
����Ŀ������(N2H4)�ֳ�����������ʱ��һ�ֿ�ȼ��Һ�壬���������ȼ�ϡ�
(1)��֪��25�桢101kPaʱ��16g N2H4����������ȫȼ�����ɵ������ų�312kJ����������N2H4��ȫȼ�յ��Ȼ�ѧ����ʽ��__________________________________��
II������ͼ��ʾ��ij�о���ѧϰС����������ȼ��ԭ�����һ����(N2H4)������ȼ�ϵ��(��ͼ��)��̽��ijЩ��ҵԭ����������װ����XΪ�����ӽ���Ĥ(��ֻ����������ͨ��)��
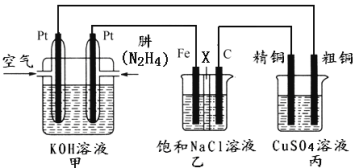
����Ҫ��ش�������⣺
(2)��װ����ͨ��________�����һ��Ϊ��������缫��ӦʽΪ��________________��
(3)��װ����ʯī�缫Ϊ_________������缫��ӦʽΪ_______________��������__________________����÷�Ӧ������һ��ʱ����ҳ��е���Һ��_______�ԡ�
(4)ͼ���ñ�װ��ģ�ҵ�е�_________________ԭ������������װ�þ�ͭ��������3.2g���������ϼ�װ��������������Ϊ___________g��
(5)��������еĴ�ͭ�缫��ΪPt�缫��������ܻ�ѧ����ʽΪ___________________________��
���𰸡�N2H4(l )+O2(g)=N2(g)+2H2O(l) ��H=-624kJ/mol ���� O2+4e-+2H2O=4OH- �� 2Cl--2e-=Cl2�� ʪ��ĵ⻯�ص�����ֽ �� ��ͭ�ľ��� 0.8 2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4
2Cu+O2��+2H2SO4
��������
(1)�����Ȼ�ѧ����ʽ��д��������ע���ʾۼ�״̬�Ͷ�Ӧ���ķ�Ӧ��д���Ȼ�ѧ����ʽ��
(2)�������������õ��ӷ�����ԭ��Ӧ��
(3)��װ����ʯī�缫���Դ�������ӣ�Ϊ�������������������ӷŵ��������������������ķ�������ʪ��ĵ��۵⻯����ֽ���۲��Ƿ���������ݵ���ܷ�Ӧ����ʽ���ж���Һ������ԣ�
(4)����ͬһ�պϻ�·��ת�Ƶ�����ȣ��г���ϵʽ��N2H4��2Cu���з�����⣻
(5)Pt�缫Ϊ���Ե缫���ö��Ե缫���CuSO4��Һ���������ӷŵ���Ⱥ�˳��ȷ����Һ���ܷ�Ӧ����ʽ��
(1)16.0g��̬��(N2H4)���ʵ���Ϊn(N2H4)=16g��32g/mol=0.5mol������������ȫȼ�����ɵ�����ˮ���ų�����312kJ��1mol��̬��(N2H4)ȼ�շ���624kJ����Ӧ���Ȼ�ѧ����ʽΪ��N2H4(l )+O2(g)=N2(g)+2H2O(l) ��H=-624kJ/mol��
(2)��װ����ͨ������ĵ缫Ϊ�����������Ͽ����е������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��O2+4e-+2H2O=4OH-��
(3)����װ��ͼ��֪����װ����ʯī�缫���Ӽ�װ�õ������������������������������ӷŵ������������缫��ӦʽΪ��2Cl--2e-=Cl2�������������ķ�������ʪ��ĵ��۵⻯����ֽ�����۲쵽ʪ��ĵ��۵⻯����ֽ��������֤������������������Ϊ���Ե缫����ⱥ��ʳ��ˮ���ܷ�Ӧ����ʽΪ��2NaCl+2H2O![]() Cl2��+H2��+2NaOH���ɼ����һ��ʱ����ҳ��е���Һ�ʼ��ԣ�
Cl2��+H2��+2NaOH���ɼ����һ��ʱ����ҳ��е���Һ�ʼ��ԣ�
(4)��װ���д�ͭ���ӵ�Դ������������������ͭ���ӵ�Դ�ĸ������������������Ϊ����ͭ��Һ�����ͼ���ñ�װ��ģ�ҵ�е�ͭ�ľ���ԭ����������ͬһ�պϻ�·�е���ת����Ŀ��ȣ����Ը��ݹ�ϵʽ��N2H4��2Cu��n(Cu)=3.2g��64g/mol=0.05mol������n(N2H4)=![]() n(Cu)=
n(Cu)=![]() ��0.05mol=0.025mol����m(N2H4)= 0.025mol��32g/mol=0.8g��
��0.05mol=0.025mol����m(N2H4)= 0.025mol��32g/mol=0.8g��
(5)��������еĴ�ͭ�缫��ΪPt�缫������Pt�缫Ϊ���Ե缫���������������Һ�е�OH-ʧȥ���ӣ���ΪO2�������ϣ���Һ�е�Cu2+��õ��ӱ�ΪCu���ʣ����Ա����ܻ�ѧ����ʽΪ2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4��
2Cu+O2��+2H2SO4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij���淴Ӧ��mA(g)+nB(g) ![]() pC(g) ��H ���ܱ������н��У���ͼ��ʾ����Ӧ�ڲ�ͬʱ��t���¶�T��ѹǿP�뷴Ӧ��B�ڻ�������еİٷֺ�����B%���Ĺ�ϵ���ߣ������߷��������ж���ȷ���ǣ� ��
pC(g) ��H ���ܱ������н��У���ͼ��ʾ����Ӧ�ڲ�ͬʱ��t���¶�T��ѹǿP�뷴Ӧ��B�ڻ�������еİٷֺ�����B%���Ĺ�ϵ���ߣ������߷��������ж���ȷ���ǣ� ��

A. T1<T2��P1>P2��m+n>p����H>0
B. T1>T2��P1<P2��m+n>p����H>0
C. T1>T2��P1<P2��m+n<p����H<0
D. T1>T2��P1>P2��m+n>p����H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ӷ�Ƥ����ǿ�ĸ�ʴ�ԣ�ʹ��ʱ������մ��Ƥ���ϣ�����������ϴ�ӵ������ǣ�������
A.�ƾ�B.����C.ϡ����D.NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������´��ڷ�Ӧ��C(s)+H2O(g)![]() CO(g)+H2(g)��H>0����ס��ҡ����������������м���һ�����ij�ʼ���ʣ����������¶ȡ���Ӧ�����ʼ�����±�����Ӧ������CO�����ʵ���Ũ����ʱ��仯��ͼ��ʾ��
CO(g)+H2(g)��H>0����ס��ҡ����������������м���һ�����ij�ʼ���ʣ����������¶ȡ���Ӧ�����ʼ�����±�����Ӧ������CO�����ʵ���Ũ����ʱ��仯��ͼ��ʾ��
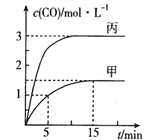
���� | �� | �� | �� |
�ݻ�(L) | 0.5 | 0.5 | V |
�¶�(��) | T1 | T2 | T1 |
��ʼ�� | 1mol C(s) 1mol H2O(g) | 1mol CO(g) 1mol H2(g) | 3mol C(s) 2mol H2O(g) |
����˵����ȷ����
A. ������������Ӧ��5��15mim���ƽ������v(CO)=0.15mol��L-1��min-1
B. �¶�ΪT1��ʱ����Ӧ��ƽ�ⳣ��K=9
C. ������������ƽ��ʱn(C)=0.2mol����T2<T1
D. �����������V=0.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)��һ�ֻ���ɫ��������������ˮ����Ŀǰ�����Ϲ��ϵĵ��Ĵ���Ч��������������
��1��Ŀǰ���Ȼ��Ƶ�ⷨ��һ�ֿɿ��Ĺ�ҵ����ClO2�ķ���(��ͼ��ʾ)��

��ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2��д����������ClO2�ĵ缫��Ӧʽ___________________��
��2����ClO2��ˮ���յõ���Һ��Ϊ�˲ⶨ����Һ��Ũ��������������ʵ����
����1��ȷ��ȡClO2��Һ10.00mL��ϡ�ͳ�100.0mL������ȡ����10.00mL�������뵽��ƿ����
����2����ϡ�������������pH��20������������KI��������ַ�Ӧ��
����3�����������Һ��ָʾ������0.2mol��L-1Na2S2O3����Һ�ζ����յ������ظ�2�Σ��������Na2S2O3��Һ��ƽ��ֵΪ20.00mL��(��֪��2Na2S2O3+I2=Na2S4O6+2NaI)
��������2������Һ����ʱ��̫������ⶨ�����__________��(����ƫ��������ƫ��������������)
������3�У��ζ��յ��������__________________ ��
��ͨ������ȷ��ԭClO2��Һ�����ʵ���Ũ�ȡ�(д���������)_______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʹ��ʯ�����ѽ�ĸ������������ȡ��������������������ͼ��

��1�������̵ĵ�II����ӦΪ��CO(g)��H2O(g) ![]() H2(g)��CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���
H2(g)��CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���
�¶�/�� | 400 | 500 | 830 |
ƽ�ⳣ��K | 10 | 9 | 1 |
���ϱ������ƶϣ��˷�Ӧ�� ���������������������ȷ�Ӧ����830���£�����ʼʱ������ܱ������г���1mo1CO��2mo1H2O����ﵽƽ���CO��ת����Ϊ ��
��2����500���������±������ʵ���������CO��H2O��H2��CO2��˳��Ͷ������ܱ������н���������II����Ӧ���ﵽƽ������й�ϵ��ȷ���� ��
ʵ���� | ��Ӧ��Ͷ���� | ƽ��ʱH2Ũ�� | ���ջ�ų������� | ��Ӧ��ת���� |
A | 1��1��0��0 | c1 | Q1 | ��1 |
B | 0��0��2��2 | c2 | Q2 | ��2 |
C | 2��2��0��0 | c3 | Q3 | ��3 |
A��2c1= c2 =c3 B��2Q1=Q2=Q3 C����1 =��2 =��3 D����1 +��2 =1
��3����һ�����ȵ��������У������жϴ����̵ĵ�II����Ӧ�ﵽƽ����� ��
��v(CO2)����v(H2O)��
�����������ܶȲ���
����������ƽ����Է����������� ������ֵ����ʵ���Ũ�Ȳ��ٸı�
����ϵ���¶Ȳ��ٷ����仯
��4����ͼ��ʾ�����̵ĵ�II����Ӧ����t1ʱ�̴ﵽƽ�⡢��t2ʱ����ı�ij������ʹŨ�ȷ����仯�������ͼ��t2ʱ�̷����ı�������� �� ��д�����֣���
��t4ʱ��ͨ���ı��ݻ��ķ�����ѹǿ����Ϊԭ�ȵ���������ͼ��t4��t5�����ڻ���CO��CO2Ũ�ȱ仯���ߣ����������ʣ����������״̬�����ֲ��䣩��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��״���£�2.24LHF����������Ϊ0.1NA
B. ij�¶��£�2LpH=12��NaOH��Һ�к�OH-����ĿΪ0.02NA
C. ��ѧ��Ӧ��ÿ����1molO2��ת�Ƶĵ�����Ϊ4NA
D. ��ϩ�ͻ�������ɵ�42g�����������й��õ��Ӷ�����Ϊ9NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com