
【题目】下列物质中含离子键的是
A.Cl2B.CO2C.KClD.CH4
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.肼(N2H4)又称联氨,常温时是一种可燃性液体,可用作火箭燃料。
(1)已知在25℃、101kPa时,16g N2H4在氧气中完全燃烧生成氮气,放出312kJ的热量,则N2H4完全燃烧的热化学方程式是__________________________________。
II.如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。
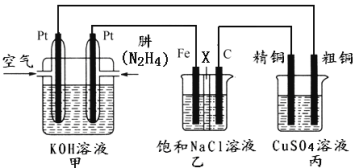
根据要求回答相关问题:
(2)甲装置中通入________气体的一极为正极,其电极反应式为:________________。
(3)乙装置中石墨电极为_________极,其电极反应式为_______________;可以用__________________检验该反应产物,电解一段时间后,乙池中的溶液呈_______性。
(4)图中用丙装置模拟工业中的_________________原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为___________g。
(5)如果将丙中的粗铜电极换为Pt电极,则丙中总化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 金刚石和石墨均为碳的同素异形体,它们燃烧时,若氧气不足生成一氧化碳,若充分燃烧生成二氧化碳,反应中放出的热量如图所示。
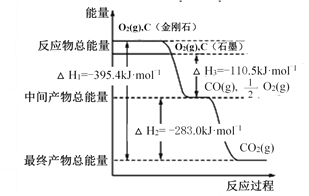
(1)等质量的金刚石和石墨完全燃烧,___________(填“金刚石”或 “石墨”)放出的热量更多,写出表示石墨燃烧热的热化学方程式:______________________________________。
(2)在通常状况下,__________________(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式:__________。
(3)12 g石墨在一定量空气中燃烧,生成气体 36 g,该过程中放出的热量为_______ 。
II. 某反应由两步反应 A、B、C 构成,它的反应能量曲线如图所示(E1、E2、E3、E4 表示活化能)。回答下列问题。

(1)A→B 过程中的 ΔH______________(填“<”或“>”)0。
(2)加入催化剂_____________________(填“能”或“不能”)改变反应的焓变。
(3)整个反应中 ΔH=_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A. 平衡向正反应方向移动B. a<c+d
C. D的体积分数变大D. A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列推断正确的是( )
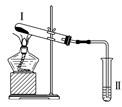
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2 为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32﹣ 的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为____________,当线路中转移0.2mol电子时,则被腐蚀铜的质量为______________ g.
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为____________________.
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(3)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
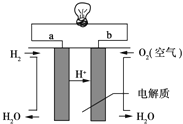
①氢氧燃料电池的总反应化学方程式是:__________________.
②电池工作一段时间后硫酸溶液的浓度___________(填“增大”、“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列因果关系表述正确的是( )
A. 硅晶体具有半导体性能,可用于光导纤维
B. NH3易溶于水,可用作制冷剂
C. 铁比铜金属性强,可用FeCl3腐蚀Cu刻制印刷电路板
D. 氯水中的次氯酸具有氧化性,可用于自来水的杀菌消毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com