
����Ŀ��I. ���ʯ��ʯī��Ϊ̼��ͬ�������壬����ȼ��ʱ����������������һ����̼�������ȼ�����ɶ�����̼����Ӧ�зų���������ͼ��ʾ��
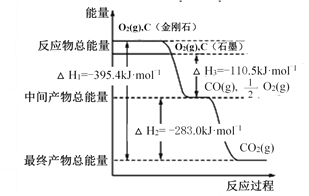
��1���������Ľ��ʯ��ʯī��ȫȼ�գ�___________(�������ʯ���� ��ʯī��)�ų����������࣬д����ʾʯīȼ���ȵ��Ȼ�ѧ����ʽ��______________________________________��
��2����ͨ��״���£�__________________(�������ʯ������ʯī��)���ȶ���д��ʯīת��Ϊ���ʯ���Ȼ�ѧ����ʽ��__________��
��3��12 gʯī��һ����������ȼ�գ��������� 36 g���ù����зų�������Ϊ_______ ��
II. ij��Ӧ��������Ӧ A��B��C ���ɣ����ķ�Ӧ����������ͼ��ʾ(E1��E2��E3��E4 ��ʾ���)���ش��������⡣

��1��A��B �����е� ��H______________(����������������)0��
��2���������_____________________(������������������)�ı䷴Ӧ���ʱ䡣
��3��������Ӧ�� ��H��_____________________________________________��
���𰸡� ���ʯ C(ʯī��s)+ O2(g)![]() CO2(g) ��H=-393.5 kJmol-1 ʯī C(ʯī��s)
CO2(g) ��H=-393.5 kJmol-1 ʯī C(ʯī��s)![]() C(���ʯ��s) ��H=+1.9 kJmol-1 252 kJ �� ���� E1+E3-E2-E4
C(���ʯ��s) ��H=+1.9 kJmol-1 252 kJ �� ���� E1+E3-E2-E4
����������1������ͼ���֪�������Ľ��ʯ��ʯī��Ƚ��ʯ�������ߣ�������ȫȼ�ս��ʯ�ų�������������1molʯī��ȫȼ�շų���������110.5kJ+283.0kJ��393.5kJ�����Ա�ʾʯīȼ���ȵ��Ȼ�ѧ����ʽΪC(ʯī��s)+ O2(g)��CO2(g) ��H=-393.5 kJmol-1����2���������Ľ��ʯ��ʯī��Ƚ��ʯ�������ߣ�������ͨ��״����ʯī���ȶ���ʯīת��Ϊ���ʯ������395.4kJ��393.5kJ��1.9kJ������ʯīת��Ϊ���ʯ���Ȼ�ѧ����ʽΪC(ʯī��s)![]() C(���ʯ��s) ��H=+1.9 kJmol-1����3��12 gʯī��1mol����ȫת��ΪCO2��44g����ȫת��ΪCO��28g�������������� 36 g����˵���������ǻ�����壬�����ɵ�CO2��CO�ֱ���xmol��ymol����x+y��1��44x+28y��36�����x��y��0.5�����Ըù����зų�������Ϊ0.5mol����110.5kJ/mol+393.5 kJ/mol����252kJ��
C(���ʯ��s) ��H=+1.9 kJmol-1����3��12 gʯī��1mol����ȫת��ΪCO2��44g����ȫת��ΪCO��28g�������������� 36 g����˵���������ǻ�����壬�����ɵ�CO2��CO�ֱ���xmol��ymol����x+y��1��44x+28y��36�����x��y��0.5�����Ըù����зų�������Ϊ0.5mol����110.5kJ/mol+393.5 kJ/mol����252kJ��
II.��1��A��B �����з�Ӧ���������������������������������H��Ӧ����0����2����������ܸı��ܣ������ܸı䷴Ӧ���ʱ䡣��3������ͼ���Ͽ�֪������Ӧ�� ��H����(E4��E1�DE3��E2)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����ʵ�����SO2��NaOH��Һ��Ӧ��������Һ�к�Na2SO3��NaHSO3�����������ʵ���֮��Ϊ3�s5����μӷ�Ӧ��SO2��NaOH�����ʵ���֮��Ϊ
A. 3�s5 B. 1�s2 C. 18�s8 D. 8�s11
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ����
A. ������̬��ȼ�ձ���̬��ȼ�շ��ȶ�
B. ��֪2H2(g)+O2(g)![]() 2H2O(g) ��H=-483.6 kJ��mol-1,��������ȼ����Ϊ 241.8 kJ��mol-1
2H2O(g) ��H=-483.6 kJ��mol-1,��������ȼ����Ϊ 241.8 kJ��mol-1
C. ��֪2C(s)+2O2(g)![]() 2CO2(g) ��H=a 2C(s)+O2(g)
2CO2(g) ��H=a 2C(s)+O2(g)![]() 2CO(g) ��H=b,��a>b
2CO(g) ��H=b,��a>b
D. ��֪ NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l) ��H=-57.3 kJ��mol-1,�� 40.0 g NaOH��ϡ��Һ��ϡ������ȫ�к�,�ų�С��57.3 kJ ������
NaCl(aq)+H2O(l) ��H=-57.3 kJ��mol-1,�� 40.0 g NaOH��ϡ��Һ��ϡ������ȫ�к�,�ų�С��57.3 kJ ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ�����һ��ʳ�����ϣ���ṹ��ʽ��ͼ��ʾ�����ڸ��л�������������в���ȷ����

�ٷ���ʽΪC12H20O2
����ʹ����KMnO4��Һ��ɫ��������ʹ��ˮ��ɫ
���ܷ����ķ�Ӧ�����У��ӳɡ�ȡ�����������Ӿ�
������ͬ���칹���п����з����廯��������ڷ����廯�����ͬ���칹����8��
��1 mol���л���ˮ��ʱֻ������1 mol NaOH
��1 mol���л�����һ�������º�H2��Ӧ��������H2Ϊ3 mol
A. �٢ڢ� B. �٢ڢ� C. �ڢܢ� D. �ڢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ۡ������ʡ���������Һ�����οɷֱ�ʹ�õ��Լ��Ͷ�Ӧ��������ȷ����
A. ��ˮ������ɫ ��Ũ���ᣬ���ɫ������Cu(OH)2��ש��ɫ����
B. Ũ���ᣬ���ɫ������Cu(OH)2��ש��ɫ��������ˮ������ɫ
C. ����Cu(OH)2��ש��ɫ��������ˮ������ɫ��Ũ���ᣬ���ɫ
D. ��ˮ������ɫ ������Cu(OH)2��ש��ɫ������Ũ���ᣬ���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ļ������й㷺��Ӧ�á�
��1�����������(NH4)2S2O8���Կ���˫��ˮ�������H2O2�����е�����Hԭ�ӱ���SO3H��ȡ����Ϊ�������ᡣ
��(NH4)2S2O8����Ԫ�صĻ��ϼ�Ϊ_________��
���ù����������Һ����ˮ�е�Mn2+����ƽ��������ӷ�Ӧ��
__S2O82-+__Mn2++__��___MnO4-+__SO42-+____��
��2�����մ�ijɷ���Na2S2O3��5H2O�������ڷ��������������������1 mol Na2S2O3��ȫ��Ӧ��ʧȥ8mol���ӡ�д����ˮ��Һ�������������ӷ���ʽ______________��
��3�����Բ���A��������Ԫ����ɵĻ����ij�о�С�鰴��ͼ��ʾ����̽������ɣ�

��A�Ļ�ѧʽΪ____________��
����֪������A�������ᷴӦ������һ�ֵ���ɫ�������һ������(��״�����ܶ�Ϊ1.518g/L)��д���÷�Ӧ�����ӷ���ʽ��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ��³�ѹ�£���5mL0.1mol/LFeCl3��Һ�еμ�����KSCN��Һ��������Ӧ��FeCl3+3KSCN![]() Fe(SCN)3+3KCl��������Һ�Ժ�ɫ���ı�������������ʹ��Һ��ɫ��dz����
Fe(SCN)3+3KCl��������Һ�Ժ�ɫ���ı�������������ʹ��Һ��ɫ��dz����
A. ����Һ�м�������KC1����
B. ����Һ�м���������ˮ
C. ����Һ�м���������ˮ����ͭ������������ȡ��
D. ����Һ�еμ�2��1 mol/L��FeCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SO2Cl2)��һ����Ҫ���л��ϳ��Լ���ʵ���ҿ�����SO2��Cl2��Ӧ��ȡ������SO2Cl2��װ����ͼ����Щ�г�װ��ʡ�ԣ���ʾ����֪SO2Cl2���۵�Ϊ- 54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ��������ˮ�ܷ������ҵ�ˮ�ⷴӦ��������������

��1��������װ��Ϻ�����װ�������Եķ�����___________________������װ�����������á�
��2������C�������������ݳ����ж�����Cl2��SO2����ֹ��Ⱦ������__________________��
��3���Լ�X��Y����������__________________������ĸ����
a.18.4 mol/L H2SO4+Cu b.4 mol/L HNO3 +Na2SO3 c.60% H2SO4+K2SO3
��4����������װ�ã���E�е��Լ���______����ȱ��װ���ҺͶ�����ʪ�������Ͷ�������֮�䷢����Ӧ�Ļ�ѧ����ʽ�ǣ�________________��
��5����Ӧ���������еĻ������뿪��ʵ�������______������Ӧ�����ĵ����������Ϊ896 ml������ת��Ϊ��״����SO2�����������õ������Ļ�����3.3 g��������ȵIJ���Ϊ ______��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����Ȼ�ѧ����ʽ�У���ѧ��Ӧ�ġ�H1>��H2����
��C(s)+O2(g)=CO2(g) ��H1 C(s)+1/2O2(g)=CO(g) ��H2
��S(s)+O2(g)=SO2(g) ��H1 S(g)+O2(g)=SO2(g) ��H2
��CaCO3(s)=CaO(s)+CO2(g) ��H1 CaO(s)+H2O(l)=Ca(OH)2(s) ��H2
A. �٢ڢ� B. �٢� C. �ڢ� D. �٢�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com