
【题目】硫、铁的化合物有广泛的应用。
(1)过二硫酸铵(NH4)2S2O8可以看成双氧水的衍生物,H2O2分子中的两个H原子被—SO3H基取代后即为过二硫酸。
①(NH4)2S2O8中硫元素的化合价为_________;
②用过二硫酸铵溶液检测废水中的Mn2+,配平下面的离子反应:
__S2O82-+__Mn2++__=___MnO4-+__SO42-+____。
(2)大苏打的成分是Na2S2O3·5H2O,常用于防毒面具中吸收氯气。若1 mol Na2S2O3完全反应,失去8mol电子。写出其水溶液吸收氯气的离子方程式______________。
(3)磁性材料A是由两种元素组成的化合物,某研究小组按如图所示流程探究其组成:

①A的化学式为____________;
②已知化合物A能与盐酸反应,生成一种淡黄色不溶物和一种气体(标准状况下密度为1.518g/L),写出该反应的离子方程式:_______________________。
【答案】 +6 5 2 8H2O 2 10 16H+ S2O32-+4Cl2+5H2O=2SO42-+8C1-+10H+ Fe3S4 Fe3S4+6H+=3H2S↑+3Fe2+ +S
【解析】(1)①H2O2分子中的两个H原子被-SO3H基取代后即为过二硫酸,取代后S元素化合价不变,则(NH4)2S2O8中硫元素的化合价为+6价;②反应中Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,Mn2+是还原剂,S2O82-中的2个-1价氧元素降低到-2价,得到2个电子,根据电子得失守恒和原子守恒可知配平的离子反应方程式为:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+。(2)Na2S2O3·5H2O中S是+2价,若1 mol Na2S2O3完全反应,失去8mol电子,这说明S元素化合价从+2价升高到+6价,即氧化产物是硫酸根,所以其水溶液吸收氯气的离子方程式为S2O32-+4Cl2+ 5H2O=2SO42- +8C1-+ 10H+。(3)C中加入KSCN,D为血红色溶液,可知C为FeCl3,D为Fe(SCN)3,可知B为Fe2O3,且n(Fe2O3)=2.400g÷160g/mol=0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶于水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有H2SO4和HI的混合溶液,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=1.28g÷32g/mol=0.04mol,因此n(Fe):n(S)=3:4,应为Fe3S4,则
①由以上分析可知,A为Fe3S4;②化合物A能与盐酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518gL-1),淡黄色不溶物为S,气体的相对分子质量为1.518×22.4L=34,为H2S气体,反应的离子方程式为Fe3S4+6H+=3H2S↑+3Fe2+ +S。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】高空大气中 O2的吸收紫外线后可变成臭氧O3,O3可分解:O3 → O2 + O,O3又和大气污染物如超音速飞机排放的NO发生反应:NO +O3→NO2 + O2,NO2 + O→ NO + O2 ,从反应的全过程判断NO的作用是
A.中间产物B.氧化剂C.最终产物D.催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是
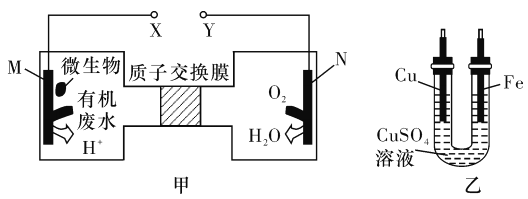
A. 铜电极应与X相连接
B. H+经过质子交换膜由右向左移动
C. 当N电极消耗0. 25 mol气体时,则铁电极增重16 g
D. M电极反应式:CO(NH2)2+H2O-6e- =CO2↑+N2↑+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 金刚石和石墨均为碳的同素异形体,它们燃烧时,若氧气不足生成一氧化碳,若充分燃烧生成二氧化碳,反应中放出的热量如图所示。
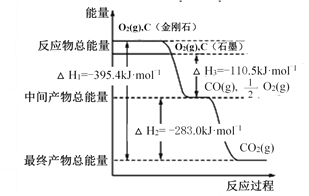
(1)等质量的金刚石和石墨完全燃烧,___________(填“金刚石”或 “石墨”)放出的热量更多,写出表示石墨燃烧热的热化学方程式:______________________________________。
(2)在通常状况下,__________________(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式:__________。
(3)12 g石墨在一定量空气中燃烧,生成气体 36 g,该过程中放出的热量为_______ 。
II. 某反应由两步反应 A、B、C 构成,它的反应能量曲线如图所示(E1、E2、E3、E4 表示活化能)。回答下列问题。

(1)A→B 过程中的 ΔH______________(填“<”或“>”)0。
(2)加入催化剂_____________________(填“能”或“不能”)改变反应的焓变。
(3)整个反应中 ΔH=_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列晶体熔化:过氧化钠、二氧化硫、氯化铵、二氧化硅,需要克服的微粒间的相互作用①共价键 ②离子键 ③分子间作用力,正确的顺序是
A. ①②②③ B. ②①②③ C. ②③②① D. ②③①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知H-H键键能为436kJ/mol,H-N键键能为391kJ/mol,根据化学方程式: N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ/mol,则N≡N键键能是
A. 946kJ/mol B. 473kJ/mol C. 211kJ/mol D. 346kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,回答下列有关问题: 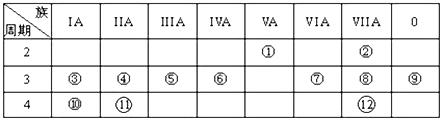
(1)画出⑥的原子结构示意图: , 写出①的气态氢化物分子的电子式 .
(2)元素④、⑩、的最高价氧化物水化物的碱性最强的为;元素②、⑦、⑧的氢化物稳定性由强到弱的顺序为(均用化学式填空).
(3)③与氧形成的化合物R2O2中所含化学键类型为 .
(4)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,有一新型燃料电池,是用两根金属做电极插入KOH溶液中,然后向X极通入A的最简单气态氢化物,向Y极通入O2 , 请写出电极反应式: 负极正极 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现有3种酸碱指示剂,其pH变色范围为:甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0。用0.100 0 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是( )
A. 溶液呈中性,可选用甲基橙或酚酞作指示剂 B. 溶液呈中性,只能选用石蕊作指示剂
C. 溶液呈碱性,可选用甲基橙或酚酞作指示剂 D. 溶液呈碱性,最好选用酚酞作指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com