
【题目】下列各项中,都属于大量元素的是( )
A. C、H、O、B B. N、P、S、Cu
C. C、H、O、Ca D. N、P、S、Fe
科目:高中化学 来源: 题型:
【题目】镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。

①A中盛装的是浓氨水,B中可盛装___,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接___、___接___、___接___。
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为____________________。
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为____________________。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、_____。
②步骤3中加氨水后反应的离子方程式为______________。
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
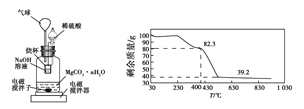
③图中气球的作用是__________________。
④上述反应后期要升温到30 ℃,主要目的是________________。
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为___(用含a的表达式表示)。
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组物质中含有的化学键类型相同的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、CO2
C.HBr、CCl4、H2O、CO2
D.Na2O2、H2O2、H2O、O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸在下列用途或反应中所表现的性质(用字母填在横线上)。
A.难挥发性 B.强酸性 C.吸水性 D.脱水性 E.强氧化性
① 浓硫酸可用作气体干燥剂 __________;
② 往晶体硫酸铜中加浓硫酸,晶体变白___________;
③ 浓硫酸与铜反应__________;
④ 运用铁制槽车和铝制槽车运输浓硫酸_________;
⑤ 浓硫酸使润湿蓝色石蕊试纸先变红后又变黑___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“组成不同生物的元素含量有不同”。对此现象的合理解释是( )
A. 组成细胞的化学元素在含量上具有差异性
B. 生物界与非生物界在元素含量上具有差异性
C. 生物根据自身生命活动的需要,有选择地从环境中吸收的元素
D. 生物体内元素的存在形式各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在定温、定容条件下,不能标志H2(g)+I2(g)![]() 2HI(g)达化学平衡的是( )
2HI(g)达化学平衡的是( )
A. 单位时间内消耗a mol H2同时消耗2a mol HI
B. 容器内的总压强不随时间变化而变化
C. 容器内H2、I2不再减少,HI不再增加
D. 单位时间内每生成a mol HI,同时有aNA个HI分子分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(C1NO)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用C12和NO制备C1NO并测定其纯度。请回答:
(I)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

(1)若制备C12发生装置选A,则反应的离子方程式为____________。若制备NO发生装置选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为________
(2)欲收集一瓶干燥纯净的氯气,选择装置,其连接顺序为:a→f→___→___→___→d→___→___→___(按气流方向,用小写字母表示),其中F装置的作用为____________。

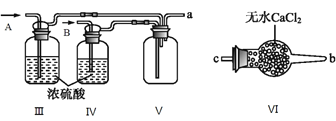
(II) 乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
(3)为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
(4)装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
(5)装置Ⅷ的烧杯中盛放的试剂是_____________(填编号①水②热水③冰水)
(6)装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com