
分析 甲元素的原子序数是11,则甲为Na,乙元素原子核外有两个电子层,最外层有6个电子,则乙为O;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素,则丙为Li.
解答 解:(1)甲的原子序数为11,为Na元素,原子核外有3个电子层,元素在周期表中位于第三周期;乙元素原子核外有两个电子层,最外层有6个电子,为O元素,在周期表中位于第VIA族;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素,丙元素为Li,
故答案为:三;VIA;Li;
(2)甲的单质与水反应的离子方程式为:2Na+2H2O═2 Na++2OH-+H2↑,
故答案为:2Na+2H2O═2 Na++2OH-+H2↑.
点评 本题考查结构性质位置关系应用,比较基础,注意对元素周期律的掌握,旨在考查学生对基础知识的巩固.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:推断题
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3 | ||
| C. | 加AgNO3溶液前未用稀硝酸酸化 | D. | 反应后的溶液中不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和 ;⑦
;⑦ 和
和 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | M与T形成的化合物具有两性 | D. | 氢化物的沸点为H2T<H2R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的电子排布图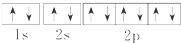 | B. | Na+的结构示意图: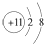 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化的电子排布式:[Na]3s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
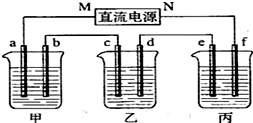
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com