
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:分析 (1)根据电池反应式知,失电子化合价升高的金属作负极,不如负极活泼的金属或导电的非金属作正极;
(2)原电池中,易失电子的电极铜为负极,银作正极,正极上得电子发生还原反应;
(3)电子从负极沿导线流向正极.
解答 解:(1)由反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)可知,在反应中,Cu被氧化,失电子,应为原电池的负极,所以X电极材料是Cu,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,铜要比电极Y材料活泼,Y可以是银,
故答案为:Cu;Ag;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为2Ag++2e-═2Ag,X(铜)电极失电子发生氧化反应,电极反应为Cu-2e-═Cu2+,
故答案为:2Ag++2e-═2Ag; Cu-2e-═Cu2+;
(3)电子从负极Cu(X)沿导线流向正极Ag(Y),
故答案为:X;Y.
点评 本题考查了原电池设计,明确原电池原理是解本题关键,根据电池反应式中得失电子的物质选取负极材料和电解质,知道原电池中正负极的判断方法,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | △H3<△H2<△H1<△H4<△H5 | B. | △H1<△H2<△H3<△H5<△H4 | ||
| C. | △H4<△H5<△H1<△H2<△H3 | D. | △H4<△H5<△H3<△H2<△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
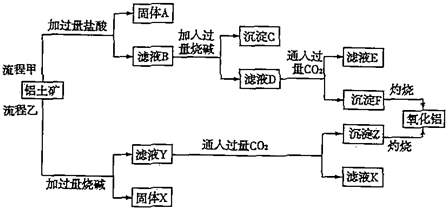
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,据此填写下列空格.
,据此填写下列空格.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因 | |
| B. | 水分解生成氢气跟氧气的同时吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2反应生成1mol H2O释放能量一定为245kJ | |
| D. | 为开发氢能,可研究设法将太阳能聚焦,产生高温使水分解产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| C. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 | |
| D. | 60g二氧化硅中含有的共价键数为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com