
 和
和 ;⑦
;⑦ 和
和 ;
;分析 质子数相同质量数(或中子数)不同的原子互称同位素;
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
具有相同分子式而结构不同的化合物互为同分异构体;
同种元素形成的不同单质互为同素异形体.
解答 解:①金刚石与石墨是由碳元素组成的不同单质,互为同素异形体;
②氧气(O2)与臭氧(O3)是由氧元素组成的不同单质,互为同素异形体;
③16O、17O和18O是氧元素的不同氢原子,互为同位素;
④CH4和CH3CH2CH3通式相同,结构相似,相差2个CH2原子团,互为同系物;
⑤乙烯和乙烷的分子式不同,结构不同,两者无关系;
⑥ 和
和 通式相同,结构相似,相差1个CH2原子团,互为同系物;
通式相同,结构相似,相差1个CH2原子团,互为同系物;
⑦ 和
和 具有相同分子式而结构不同,互为同分异构体;
具有相同分子式而结构不同,互为同分异构体;
故答案为:③;⑦.
点评 本题考查“五同”比较,难度不大,侧重考查学生的辨别能力,根据概念逐项判断即可.


科目:高中化学 来源: 题型:选择题

| A. | 化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因 | |
| B. | 水分解生成氢气跟氧气的同时吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2反应生成1mol H2O释放能量一定为245kJ | |
| D. | 为开发氢能,可研究设法将太阳能聚焦,产生高温使水分解产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性X>Y>Z | |
| B. | X、Y、Z形成的阴离子还原性逐渐增强 | |
| C. | 原子半径X<Y<Z | |
| D. | X、Y、Z的气态氢化物稳定性由弱到强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A. | ③④ | B. | ①③④ | C. | ②⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Z、Y、W的原子半径依次减小 | |
| B. | 若W与Y的原子序数相差5,则二者形成化合物的化学式可能为Y3W2 | |
| C. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| D. | W与X形成的化合物只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数是K层电子数的3倍 |
| X | 一种同位素可测定文物年代 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
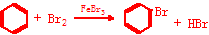 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com