
【题目】某课外兴趣小组用右图装置进行实验,试回答: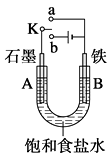
(1)若开始时开关K与a连接,则A电极反应式为。
(2)若开始时开关K与b连接,这种方法经常用于金属的防护,这种防护措施叫做 , 则A电极反应式为;B电极反应式为。
(3)开关K与b连接,将饱和食盐水换成CuSO4溶液,则A电极反应式为 , 该反应的离子方程式为 ,电解一段时间后(溶液仍然为蓝色),溶液的pH值将(填“变大”、“变小”、“不变”),若将电解质溶液恢复至原状,应补充 。
【答案】
(1)O2 + 4e-+ 2H2O = 4OH-
(2)外加电流的阴极保护法,2Cl- -2e- =Cl2↑,2H++2e-=H2↑
(3)4OH-- 4e- = O2 ↑+2H2O,2Cu2+ + 2H2O ![]() 2Cu+O2↑+ 4H+,变小,CuO(或CuCO3)
2Cu+O2↑+ 4H+,变小,CuO(或CuCO3)
【解析】(1)若开始时开关K与a连接,则该装置是原电池,A是正极、B是负极,铁发生类似吸氧腐蚀的原电池反应,A电极反应式为O2 + 4e-+ 2H2O = 4OH-。(2)若开始时开关K与b连接,A电极与电源正极相连接,所以A是阳极,B是阴极,这种方法经常用于金属的防护,这种防护措施叫做外加电流的阴极保护法,此时阳极上是溶液中的阴离子放电,则A电极反应式为2Cl- -2e- =Cl2↑;阴极上是溶液中的氢离子放电,B电极反应式为2H++2e-=H2↑。(3)开关K与b连接,将饱和食盐水换成CuSO4溶液,阳极上是溶液中的氢氧根放电生成氧气,阴极上是铜离子放电生成铜,则A电极反应式为4OH-- 4e- = O2 ↑+2H2O,该反应的离子方程式为2Cu2+ + 2H2O ![]() 2Cu+O2↑+ 4H+,因此,溶液的pH值将变小。因为电解质中只损失了铜和氧两种元素,若将电解质溶液恢复至原状,应补充CuO(或CuCO3也可以,其与硫酸反应后可将多余的元素转化为二氧化碳逸出)。
2Cu+O2↑+ 4H+,因此,溶液的pH值将变小。因为电解质中只损失了铜和氧两种元素,若将电解质溶液恢复至原状,应补充CuO(或CuCO3也可以,其与硫酸反应后可将多余的元素转化为二氧化碳逸出)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d的原子序数依次增大,这四种元素形成的单质依次为m、n、p、q;x、y、z是由这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃时,0.01mol·L-lw溶液中,![]() =1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
=1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
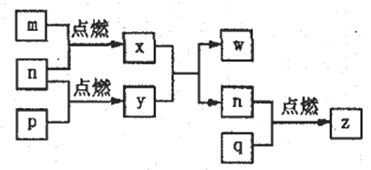
A. 原子半径的大小:a<b<c<d
B. 简单氢化物的沸点:b>d
C. y的电子式:![]()
D. y、w含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某城市某日空气质量报告:
污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
实验一:用下图所示装置进行实验。

(1)A装置的作用是_________(填“干燥”或“氧化”)SO2气体。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变_______色(填“蓝色”或“红色”或“不变色”),说明SO2与水反应生成一种酸。
(3)D装置的作用是_________ ,并写出化学反应方程式_____________________。
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH_______7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4。
(查阅资料) SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作_________(填“催化剂”或“氧化剂”)。
(探究结论)SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(知识联想)
(1)酸雨造成的危害是:______________________________(举一例)。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为____________,是造成酸雨的另一主要原因。
(提出建议)该市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加人_________(填“水”或“乙醇”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+3B==2C+4D(A、B、C、D均为气态),在四种不同情况下的反应速率最快的是
A. v(A)=0.1mol/(L·s) B. v(B) =0.6mol/(L·s)
C. v(C) =0.6mol/(L·s) D. v(D) =0.8mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的办法。塑料袋、废纸、旧橡胶制品等属于
A. 无机物 B. 非金属单质 C. 纯净物 D. 有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,其悬浊液可吸收烟气中SO2,所得酸性浸出液又可用于制备高纯硫酸锰,其一种工艺流程如下图图1所示。已知金属单质的活动顺序为Al>Mn>Fe>Ni。回答下列问题:
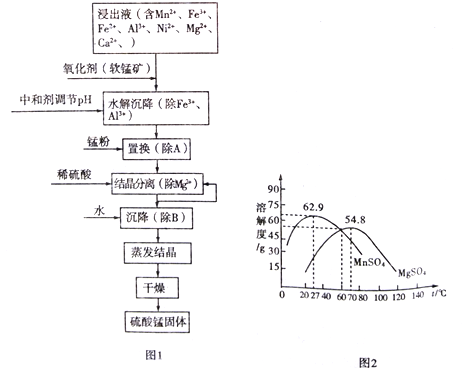
(1)用离子方程式表示加入“氧化剂(软锰矿)”作用:_________________________。
(2)已知:Ksp[Al(OH)3]=1.0×10-33 Ksp[Ni(OH)2]=1.6×10-15
Ksp[Mn(OH)2]=4.0×10-14 Ksp[Fe(OH)3]=2.6×10-39
“水解沉降”中:
①“中和剂”可以是__________(填标号)。
A.Al2O3 B.MgO C.H2SO4 D.MnO2
②溶液的pH应不低于______________。(离子浓度小于1×10-6mol/L时,即可认为该离子沉淀完全)
(3)“置换”的目的是____________________(用离子方程式表示)。
(4)“结晶分离”中的部分物质的溶解度曲线如上图图2所示。结晶与过滤过程中,体系温度均应维持在______________℃(填“27”、“60”或“70”)。
(5)“草酸钠一高锰酸钾返滴法”可测定软锰矿中MnO2的纯度(假设杂质不参与反应):取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1 mol/LNa2C2O4溶液(足量),最后用c2mol/L的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为________________________。
②该样品中MnO2的质量分数为______(假定杂质不参与反应,列出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现通过以下步骤由 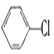 制备
制备 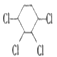
(1)写出A,B的结构简式:A , B。
(2)从左到右依次填写每步反应所属的反应类型(a.取代反应;b.加成反应;c.消去反应。只填字母代号)。
(3)写出反应A→B所需的试剂和条件:。
(4)写出④和⑤的化学方程式 , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
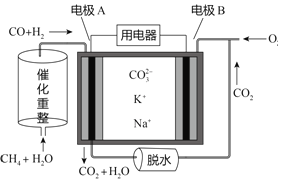
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移8mol电子
3H2+CO,每消耗1molCH4转移8mol电子
B. 电池工作时,CO32-向电极A移动
C. 电极A上只有H2参与电极反应,反应式为H2+2OH--2e-=2H2O
D. 电极B上发生的电极反应为O2+4e-=2O2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com