
【题目】碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
(1)某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸____________mL(保留两位小数)。
(2)某溶液组成如表一:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 814.8 | 400.3 | 97.3 |
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 137.7 | 428.8 | 97.3 |
计算析出的碳酸氢钠晶体的质量(保留1位小数)。____________
(3)将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留1位小数)。____________
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式____________
【答案】17.80 1044.6 659.1 NaHCO3·Na2CO3·2H2O
【解析】
(1)根据碳酸氢钠样品消耗的氢离子物质的量相等,计算出消耗硫酸的体积;
(2)先求出通入二氧化碳消耗的碳酸钠的质量,然后根据反应计算出生成的碳酸氢钠的质量,再计算析出的碳酸氢钠的质量;
(3)根据碳酸氢钠减少的质量,计算出生成的碳酸钠的质量,再用814.8kg减掉现有的碳酸钠质量,就是需要添加的碳酸钠质量;
(4)先根据二氧化碳的体积计算出生成的碳酸氢钠和反应的碳酸钠质量,反应后溶液中含碳酸氢钠504kg,减掉生成的碳酸氢钠,得到原晶体中的碳酸氢钠质量,最后计算出水的质量,就可以求出晶体的化学式。
(1)根据反应可知消耗的H2SO4物质的量是HCl的一半,即0.1×20×0.5=0.05618×V,V=1780mL。
(2)
(2)设生成的碳酸氢钠质量为m,向溶液中通入二氧化碳,发生了反应:Na2CO3+CO2+H2O=2NaHCO3,反应消耗的碳酸钠的质量是:814.8kg-137.7kg=677.1kg![]()
m=![]() =1073.1kg,则析出的碳酸氢钠晶体的质量:1073.1+400.3-428.8=1044.6 kg
=1073.1kg,则析出的碳酸氢钠晶体的质量:1073.1+400.3-428.8=1044.6 kg
(3)
x=17.98 kg,则补加的碳酸钠质量814.8-137.7-17.98=659.1 kg.
(4)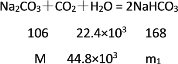
m=212 kg,m1=336 kg,则452kg晶体中含Na2CO3212 kg,NaHCO3168 kg,水72 kg,
因此该晶体的化学式为NaHCO3·Na2CO3·2H2O。


科目:高中化学 来源: 题型:
【题目】二氧化硫是造成大气污染的主要有害气体之一,工业制备硫酸的接触室中二氧化硫不能完全转化为三氧化硫,尾气必须处理。某兴趣小组模拟接触室中反应,如图是分别在三种不同实验条件下进行反应,反应物二氧化硫的浓度随时间的变化。
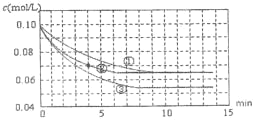
(1)工业制硫酸的接触室中用二氧化硫与氧气制三氧化硫的生产条件为_______。
(2)实验②,0~4min 平均反应速率v(O2)=______。
(3)实验③可能改变的条件是什么:______请简述理由。______(已知正反应放热)
(4)二氧化硫尾气可以用氨水吸收,最终的产物可能有(NH4)2SO4、(NH4)2SO3、NH4HSO3。若三者的物质的量浓度相同时,铵根离子浓度由大到小的顺序为______。
(5)浓硫酸是常见的干燥剂,请解释不能干燥硫化氢与氨气的原因_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸
B.合成氨工业中使用铁触媒做催化剂
C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体
D.热的纯碱溶液去油污效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
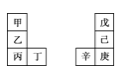
A.丙与庚的原子序数相差3
B.气态氢化物的热稳定性:戊>己>庚
C.乙所在周期元素中,其简单离子的半径最大
D.常温下甲的单质在水中反应要比乙剧烈很多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)铝原子核外电子云有___种不同的伸展方向,有___种不同运动状态的电子。
(2)镓(Ga)与铝同族。写出镓的氯化物和氨水反应的化学方程式___。
(3)硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成氧化物形式___。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式为___。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为___。
(4)用铝和金属氧化物反应制备金属单质是工业上常用的方法。如:2Al+4BaO![]() 3Ba↑+BaOAl2O3。常温下Al的金属性比Ba的金属性___(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是___。
3Ba↑+BaOAl2O3。常温下Al的金属性比Ba的金属性___(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是___。
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaOAl2O3比Al2O3稳定 d.Ba的沸点比Al的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是

A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe2e =Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH4(g)+2O2(g)= CO2(g)+2H2O(l); △H=-890kJ/mol。当一定量的CH4 (g) 完全燃烧生成CO2(g)和H2O(l) 所放出的热量为74kJ时,所需要空气在标况下的体积约为(空气中N2:O2体积比为4:1计) ( )
A.37.24LB.18.62LC.9.3LD.20.50L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及部分重要化合物的相互转化如图所示。
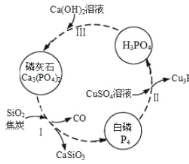
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为______。
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有______。
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
成分 | CaO | P2O5 | SO3 | CO2 |
质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(3)磷灰石中,碳元素的质量分数为______%(保留两位小数)。
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4______g(保留两位小数)。
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的单质及其化合物性质多样,用途广泛。完成下列填空:
科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO![]() 2CO2+N2+Q(Q>0)。
2CO2+N2+Q(Q>0)。
在某温度下测得该反应在不同时间的CO浓度如下表:
浓度(mol/L) 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)该反应平衡常数K的表达式为___;温度升高,K值___(选填“增大”“减小”“不变”);前2s的平均反应速率v(N2)=___;若上诉反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是___。
(2)工业合成氨的反应温度选择500℃左右的原因是___。
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是___。
A.N2、H2、NH3的浓度之比为1:3:2
B.容器内的压强保持不变
C.N2、H2、NH3的浓度不在变化
D.反应停止,正、逆反应的速率都等于零
(4)常温下向1molHCl的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是___;在通入NH3的过程中溶液的导电能力___(选填“变大”“变小”“几乎不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com