
【题目】已知CH4(g)+2O2(g)= CO2(g)+2H2O(l); △H=-890kJ/mol。当一定量的CH4 (g) 完全燃烧生成CO2(g)和H2O(l) 所放出的热量为74kJ时,所需要空气在标况下的体积约为(空气中N2:O2体积比为4:1计) ( )
A.37.24LB.18.62LC.9.3LD.20.50L
科目:高中化学 来源: 题型:
【题目】交通运输部在南海华阳礁举行华阳灯塔和赤瓜灯塔竣工发光仪式,宣布两座大型多 功能灯塔正式发光并投入使用。镁-海水电池可为灯塔提供能源,其装置如图所示。下列有关镁-海水电池的说法正确的是( ).
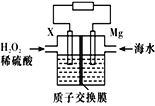
A.镁被还原
B.该电池工作一段时间后,左侧溶液质量减轻
C.正极的电极反应式为H2O2+2e-+2H+=2H2O
D.若电池工作时,SO42-从交换膜左侧向右侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
2NH3(g)(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
A.加催化剂,v正、v逆都发生变化,且变化的程度相等
B.加压,v正、v逆都增大,且v正增大的程度大于v逆增大的程度
C.降温,v正、v逆都减小,且v正减小的程度小于v逆减小的程度
D.增大氮气的浓度的时刻,v正、v逆都增大,且v正增大程度大于v逆增大程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
(1)某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸____________mL(保留两位小数)。
(2)某溶液组成如表一:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 814.8 | 400.3 | 97.3 |
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 137.7 | 428.8 | 97.3 |
计算析出的碳酸氢钠晶体的质量(保留1位小数)。____________
(3)将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留1位小数)。____________
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某甲酸溶液中含有甲醛,用下列方法可以证明的是
A.加入足量的新制氢氧化铜并加热煮沸,有砖红色的沉淀
B.加入过量的氢氧化钠充分反应后的溶液能发生银镜反应
C.将试液进行酯化反应后的混合液能发生银镜反应
D.加入足量氢氧化钠后,蒸馏出的气体通入新制的氢氧化铜悬浊液加热有砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
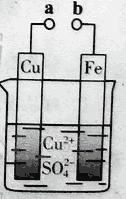
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源、材料已成为当今科学研究的热点。请回答下列问题:
(1)单质A的燃烧热大,可作燃料。已知A为短周期元素,其气态原子逐个失去1~4个电子所需能量(电离能)如表所示。若该原子核外电子有三层,则该元素位于周期表______族,写出A燃烧后形成的氧化物的电子式:______.
I1 | I2 | I3 | I4 | … | |
电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | … |
(2)如图是超导材料元素在周期表中的分布,上述元素的短周期元素中原子半径最大的是______(填元素符号),其原子最外层有______种运动状态不同的电子,写出其最高价氧化物对应水化物在水溶液中的电离方程式:______。
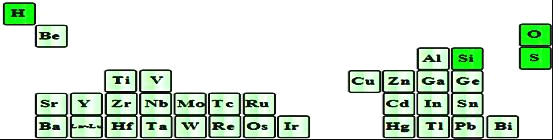
(3)上述主族元素中有两种原子可以形成的五核分子,其化学键键长和键角都相等,则该分子的空间构型为______,该物质为______分子(选填“极性”或“非极性”)。
(4)铁单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1mol该易燃气体放出37.68kJ热量,请写出此反应的热化学方程式:______。
(5)取适量Al、Mg合金样品置于烧杯中,加入20mL 1mol/L的NaOH溶液,恰好完全反应。下列叙述正确的是______(选填编号)。
a.Mg作负极,Al作正极
b.若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少2/3
c.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL![]()
![]() 溶液中滴加
溶液中滴加![]() NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
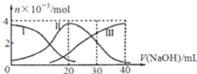
A.滴加过程中当溶液呈中性时,![]()
B.当![]() 时,则有:
时,则有:![]()
C.H![]() 在水中的电离方程式是:H
在水中的电离方程式是:H![]() ;
;![]()
D.当![]() 时,则有:
时,则有:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)元素N的价电子数排布式为3d24s2,其氯化物NCl4和LiBH4反应可制得储氢材料N(BH4)3。
①元素N在周期表中的位置为__,该原子具有__种运动状态不同的电子。
②化合物LiBH4中含有的化学键有__,BH4-的立体构型是_,B原子的杂化轨道类型是__,B原子轨道表达式为__。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+__H-(填“>”“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:M的最高正价是__。
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
(3)NaH具有NaCl型晶体结构,Na+的配位数为__,晶体的堆积方式为__,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为pm,NaH的理论密度是__g·cm-3。(仅写表达式,不计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com