
����Ŀ�����ʹ�������ǿ����������ܵ���Ҫ�о�����
��1��Ԫ��N�ļ۵������Ų�ʽΪ3d24s2�����Ȼ���NCl4��LiBH4��Ӧ���Ƶô������N(BH4)3��
��Ԫ��N�����ڱ��е�λ��Ϊ__����ԭ�Ӿ���__���˶�״̬��ͬ�ĵ��ӡ�
�ڻ�����LiBH4�к��еĻ�ѧ����__��BH4-�����幹����_��Bԭ�ӵ��ӻ����������__��Bԭ�ӹ������ʽΪ__��
��2�������⻯���Ǿ������÷�չǰ���Ĵ�����ϡ�
��LiH�У����Ӱ뾶��Li��__H��(����������������������)��
��ij��������Ƕ����ڽ���Ԫ��M���⻯�M�IJ��ֵ��������±���ʾ��M�����������__��
I1/kJ��mol-1 | I2/kJ��mol-1 | I3/kJ��mol-1 | I4/kJ��mol-1 | I5/kJ��mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
��3��NaH����NaCl�;���ṹ��Na������λ��Ϊ__������Ķѻ���ʽΪ__����֪NaH����ľ�������a=488pm��Na���뾶Ϊ102pm��H���İ뾶Ϊpm��NaH�������ܶ���__g��cm-3��(��д����ʽ��������)
���𰸡��������ڵ���B�� 22 ���Ӽ������ۼ�����λ�� �������� sp3 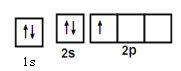 �� +2 6 �������ܶѻ�
�� +2 6 �������ܶѻ� ![]() g��(488��10��10cm)3
g��(488��10��10cm)3
��������
��1����Ԫ��N�ļ۵������Ų�ʽΪ3d24s2������Ԫ�أ�ԭ��������22��Ԫ��N�����ڱ��е�λ��Ϊ�������ڵ���B�壬Tiԭ�Ӻ�����22�����ӣ�������22�ֲ�ͬ�˶�״̬�ĵ��ӡ�
�ʴ�Ϊ���������ڵ���B�壻22��
��������LiBH4�У�Li+��BH4-���γ����Ӽ���B��H���γɹ��ۼ���������һ�����ۼ�����λ����LiBH4�к��еĻ�ѧ�������Ӽ������ۼ�����λ����
BH4����Bԭ�Ӽ۲������=4+![]() =4������Ϊsp3�ӻ����Ҳ����µ��Ӷԣ����������幹�ͣ�Bԭ�ӹ������ʽΪ
=4������Ϊsp3�ӻ����Ҳ����µ��Ӷԣ����������幹�ͣ�Bԭ�ӹ������ʽΪ ��
��
�ʴ�Ϊ�����Ӽ������ۼ�����λ�����������壻sp3 �� ��
��
��2�������Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С���������Ӱ뾶��Li����H�����ʴ�Ϊ������
����Ԫ�صĵ�III�����ܾ��������Ԫ�����ڵ�IIA�壬�������Ϊ+2���ʴ�Ϊ��+2��
��3��NaH����NaCl�;���ṹ����Na�������Cl-λ��Na�������¡�ǰ�����ң�Na������λ��Ϊ6������Ķѻ���ʽΪ�������ܶѻ���NaH����NaCl�;���ṹ��NaH����ľ�������a=488pm���ⳤ����Na���뾶Ϊ102pm��H���İ뾶Ϊ![]() =142pm���þ����������Ӹ���=8��
=142pm���þ����������Ӹ���=8��![]() +6��
+6��![]() =4�������Ӹ���=12��
=4�������Ӹ���=12��![]() +1=4��NaH�������ܶ�����=
+1=4��NaH�������ܶ�����= ==
==![]() g��(488��10��10cm)3=
g��(488��10��10cm)3= 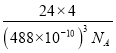 g��cm-3=
g��cm-3=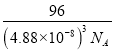 g��cm-3���ʴ�Ϊ��6���������ܶѻ���
g��cm-3���ʴ�Ϊ��6���������ܶѻ���![]() g��(488��10��10cm)3��
g��(488��10��10cm)3��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪CH4(g)��2O2(g)= CO2(g)��2H2O(l)�� ��H����890kJ/mol����һ������CH4 (g) ��ȫȼ������CO2(g)��H2O(l) ���ų�������Ϊ74kJʱ������Ҫ�����ڱ���µ����ԼΪ��������N2:O2�����Ϊ4:1�ƣ� �� ��
A.37.24LB.18.62LC.9.3LD.20.50L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ��������ʹҩ������������һ�ֺϳ�·�ߣ�
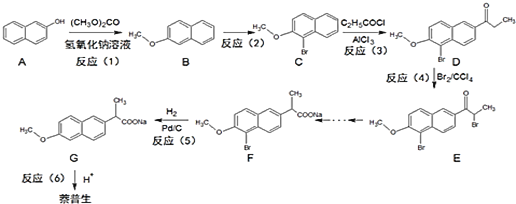
��֪������![]() ���Ļ�ѧ�����뱽���ơ�
���Ļ�ѧ�����뱽���ơ�
���������գ�
(1)��Ӧ(1)�ķ�Ӧ������___��A�ķ���ʽ��___��
(2)��Ӧ(2)���Լ���������___����Ӧ(3)�IJ�����D��___���ѧʽ����
(3)������������С�մ�ͬʱ���õ�ԭ����___���û�ѧ����ʽ��ʾ����
(4)X��Dһ��ͬ���칹�壬���������ص㣺
�������������������ȡ��������ͬһ�������ϣ�����NaOH��Һ����ȫˮ�⣬��������ˮ���������5�ֻ�ѧ������ͬ���⡣д��X���ܵĽṹ��ʽ___��
(5)���ñ���CH3COClΪԭ�Ϻϳɱ���ϩ�������Լ���ѡ��___��
���úϳ�·������ͼ��ʾΪ��A![]() B��
B��![]() Ŀ������
Ŀ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĵ��ʼ��仯�������ʶ�������;�㷺�����������գ�
��ѧ�������о����ô������������ٷɻ�β���е�NO��COת���CO2��N2��2NO+2CO![]() 2CO2+N2+Q(Q��0)��
2CO2+N2+Q(Q��0)��
��ij�¶��²�ø÷�Ӧ�ڲ�ͬʱ���COŨ�����±���
Ũ�ȣ�mol/L�� ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
c��CO�� | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
��1���÷�Ӧƽ�ⳣ��K�ı���ʽΪ___���¶����ߣ�Kֵ___��ѡ��������������С��������������ǰ2s��ƽ����Ӧ����v��N2��=___�������߷�Ӧ���ܱ������з������ﵽƽ��ʱ�����NOת���ʵĴ�ʩ֮һ��___��
��2����ҵ�ϳɰ��ķ�Ӧ�¶�ѡ��500�����ҵ�ԭ����___��
��3��ʵ�����ڹ̶��ݻ����ܱ������м���1mol������3mol����ģ�ҵ�ϳɰ�����Ӧ��һ���������Ѵﵽƽ��ı�־��___��
A.N2��H2��NH3��Ũ��֮��Ϊ1��3��2
B.�����ڵ�ѹǿ���ֲ���
C.N2��H2��NH3��Ũ�Ȳ��ڱ仯
D.��Ӧֹͣ�������淴Ӧ�����ʶ�������
��4����������1molHCl��ϡ�����л���ͨ��1molNH3����Һ����仯���Բ��ƣ�����Ӧ��������Һ������Ũ���ɴ�С��˳����___����ͨ��NH3�Ĺ�������Һ�ĵ�������___��ѡ�������������С����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡһ���ñ��͵�NaCl��Һ��ʪ��pH��ֽ������Ǧ��о���缫����ֱͨ����Դ��һ��ʱ�����a�缫����ֽ�Ӵ�������һ��˫ɫͬ��Բ����ȦΪ��ɫ����Ȧ��dz��ɫ��������˵���������( )

A. b�缫������B. a�缫���Դ����������
C. ��������ˮ��������D. b�缫������Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��й��������ϵ������������ȷ���ǣ� ��
ѡ�� | �� | ���ϵ | �������� |
A | C60��C70��C540 | ͬλ�� | ����ֻ���Ǽ��Թ��ۼ� |
B | ���顢2��2���������� | ͬ���칹�� | ���³�ѹ�³���̬ |
C |
| ͬ�������� | ������������ʱ�Ĵ��� |
D | ���ᡢӲ֬�� | ͬϵ�� | �ܷ���������Ӧ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ�٣�CO(g)��CuO(s) ![]() CO2(g)��Cu(s)�ͷ�Ӧ�ڣ�H2(g)��CuO(s)
CO2(g)��Cu(s)�ͷ�Ӧ�ڣ�H2(g)��CuO(s) ![]() Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ�ۣ�CO(g)��H2O(g)
Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ�ۣ�CO(g)��H2O(g) ![]() CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(�� ��)
CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(�� ��)
A.��Ӧ�ٵ�ƽ�ⳣ��K1��![]()
B.��Ӧ�۵�ƽ�ⳣ��K��![]()
C.���ڷ�Ӧ�ۣ�����ʱ���¶����ߣ�H2Ũ�ȼ�С����÷�ӦΪ���ȷ�Ӧ
D.���ڷ�Ӧ�ۣ����º����£�����ѹǿ��H2Ũ��һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����������ָ����Һ��һ���ܴ����������
A.0.1mol��L��1NaHCO3��Һ��K+��Al3+��NO3-��SO42-
B.![]() 10-12����Һ�У�Na+��K+��ClO-��CO32-
10-12����Һ�У�Na+��K+��ClO-��CO32-
C.��ʹ��ɫʯ����ֽ��������Һ��NH4+��K+��Cl-��NO3-
D.ˮ�����c(H+)=10��11mol��L��1����Һ�У�Na+��Ca2+��HCO3-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H2O2��H2SO4�Ļ����Һ�ɸ�ʴӡˢ��·���ϵ�ͭ�����Ȼ�ѧ����ʽΪCu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ��H
��֪��Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ��H1=64kJ��mol-1
��2H2O2(l)=2H2O(l)+O2(g) ��H2=-196kJ��mol-1
��H2(g)+![]() O2(g)=H2O(l) ��H3=-286kJ��mol-1
O2(g)=H2O(l) ��H3=-286kJ��mol-1
����˵������ȷ���ǣ� ��
A.��Ӧ�ٿ�ͨ��ͭ���缫���ϡ��H2SO4����ʵ��
B.��Ӧ�����κ������¶����Է�����
C.��H2(g)+![]() O2(g)=H2O(g) ��H4������H4����H3
O2(g)=H2O(g) ��H4������H4����H3
D.��H=-320kJ��mol-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com