
【题目】有U、V、W、X、Y、Z六种前四周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息比 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
W | 基态时, 2p 轨道处于半充满状态 |
X | 自然界中含量最多 |
Y | 是第四周期元素中未成对电子数最多的元素 |
请回答下列问题:
(1)W、X、V第一电离能由大到小顺序:________________________(用元素符号表示)
(2)V的最高价氧化物对应含氧酸中,酸根的立体构型为:_________,中心原子的杂化方式为:_______________;
(3)Y的基态原子的价电子排布图为____________________________;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子。两者沸点的关系为乙______丙(填“>”或“<”),原因是__________________________________________;
(5)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中属于____________晶体
【答案】N>O>C 平面三角形 sp2 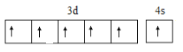 < 水分子间形成氢键 原子
< 水分子间形成氢键 原子
【解析】
U所处的周期数、族序数分别与其原子序数相等,故U为氢;
V基态时,电子分布在三个能级上,且各能级中电子数相等,则核外电子排布为1s22s22p2,则V为碳元素;
W基态时,2p 轨道处于半充满状态,核外电子排布为1s22s22p3,则W为氮元素;
X自然界中含量最多,故X为氧元素;
Y是第四周期元素中未成对电子数最多的元素,故Y为铬元素;
(1)三种元素处于同一周期,N的2p能级处于半充满状态,第一电离能最大,W、X、V第一电离能由大到小顺序:N>O>C(用元素符号表示),故答案为:N>O>C;
(2)V为碳元素,V的最高价氧化物对应含氧酸中,C原子的价电子对=3+![]() =3,酸根的立体构型为:平面三角形,中心原子的杂化方式为:碳原子采取sp2杂化;故答案为:平面三角形;sp2;
=3,酸根的立体构型为:平面三角形,中心原子的杂化方式为:碳原子采取sp2杂化;故答案为:平面三角形;sp2;
(3)铬为24号元素,基态原子的核外电子排布式为[Ar]3d54s1,Y的基态原子的价电子排布图为 ,故答案为:
,故答案为: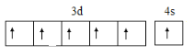 ;
;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子,乙和丙分别是CH4、H2O。两者沸点的关系为乙<丙(填“>”或“<”),水分子间形成氢键,增大分子间作用力,故答案为:<;水分子间形成氢键;
(5)V与W原子结合形成的V3W4晶体,化学式C3N4,其硬度比金刚石大,符合原子晶体的特征,则V3W4晶体中属于原子晶体,故答案为:原子。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.22.4L乙烯中C-H键数为4NA
B.1.5g甲基中电子数为1.0NA
C.标准状况下,22.4L苯中含有的碳原子数为6.0NA
D.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物是苯环上一个
的有机物是苯环上一个![]() 原子被取代后得到的物质,下列判断错误的是( )
原子被取代后得到的物质,下列判断错误的是( )
A.![]() 属于苯的同系物
属于苯的同系物
B.该有机物的结构有4种
C.该有机物的某种结构的核磁共振氢谱有4组峰
D.该有机物所有结构的一溴代物种类相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池相比锂离子电池具有高安全、长寿命、低成本的特点,有望成为下一代电池。某钠离子电池放电时的总反应为Na(1-x)MO2+NaxCn═NaMO2+nC,如图表示其充电过程。有关该电池的说法错误的是( )
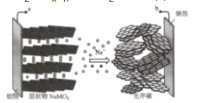
A.充电时,a与外加电源正极相连
B.放电时,外电路电子由b流向a
C.充电时,无序碳上发生的反应为nC+xNa++xe-═NaxCn
D.用该电池电解精炼铜,当电池中迁移1molNa+时,理论上可获得64g纯铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断正误,正确的画“√”,错误的画“×”
(1)2 g D![]() O中含有的质子数、中子数均为NA_______
O中含有的质子数、中子数均为NA_______
(2)过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA_______
(3)1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA_______
(4)标准状况下,5.6 L NO和5.6 L O2组成的混合气体中所含原子数为NA_______
(5)0.1 mol钠和O2在一定条件下反应完全生成Na2O和Na2O2混合物时,失去电子数为0.1NA _______
(6)14 g乙烯和丙烯混合气体中的氢原子数为2NA_______
(7)在1L 0.1mol·L﹣1碳酸钠溶液中,阴离子总数大于0.1NA _______
(8)高温下,16.8 g Fe与足量水蒸气完全反应失去电子数为0.8 NA _______
(9)标准状况下,氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为4NA_______
(10)常温常压下 ,1 L液态水中含有的H+数目为10-7NA_______
(11)一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3 NA _______
(12)标准状况下,2.24 L CCl4含有的共价键数为0.4NA_______
(13)标况下,22.4L己烷的分子个数为NA_______
(14)含1 mol H2SO4的浓硫酸与足量Zn反应转移的电子总数为2NA_______
(15)在1L 0.1mol·L﹣1氯化铵溶液中,NH4+ 和NH3·H2O的个数之和为NA _______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.苯的溴化实验中需要的仪器有酒精灯,三颈烧瓶,冷凝管,锥形瓶等
B.尿素和甲醛在一定条件下能反应生成高分子材料脲醛树脂
C.煤的气化是指高温下煤与水蒸气作用得到CO、H2、CH4 等气体
D.石油的加工过程中,有催化重整和加氢裂化等工艺,催化重整是获得芳香烃的主要途径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在 3个体积均为 20L的密闭真空容器中发生如下反应(假设容器体积不变,固体试样体积忽略不计):NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
容器 | 温度/℃ | 起始物质的量(n/mol) | 平衡物质的量(n/mol) | ||
n(NH2COONH4) | n(NH3) | n(CO2) | n(CO2) | ||
I | 15 | 1.00 | 0 | 0 | 0.016 |
II | 15 | 2.00 | 0 | 0 | a |
III | 35 | 0 | 4.00 | 2.00 | b |
下列说法不正确的是
A.当反应进行到30min时测得容器Ⅰ中混合气体的物质的量为 0.036mol,则30min 内该反应的平均速率 v(NH3)=4×10-5mol·L-1·min-1
B.当密闭容器中的二氧化碳的体积分数不变时,不能说明该反应到达了平衡
C.若该反应的正反应为吸热反应,则 b一定大于0.032
D.达到平衡时反应物的转化率:α(Ⅰ)> α (Ⅱ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种形状像布袋结构的烯烃分子,其形状和结构如图所示,有关说法不正确的是( )

A. 该烯烃的分子式为C5H4
B. 该分子所有碳原子在同一平面
C. 1 mol该有机物最多可与2 mol Br2发生加成反应
D. 与其互为同分异构体且只含三键的链烃不止—种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的一部分如图所示,W、X、Y、Z均为短周期主族元素,X与Z的最高正价之和与W的相等。下列说法错误的是
![]()
A.原子半径:X>Y>Z>W
B.X2W2中含有离子键和共价键
C.Y的最高价氧化物对应的水化物难溶于水
D.将由X、Z的单质组成的混合物放入冷水中,Z的单质不发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com