
【题目】可逆反应:aA(g)+bB(g)![]() cC(g)+dD(g);根据图回答:
cC(g)+dD(g);根据图回答:
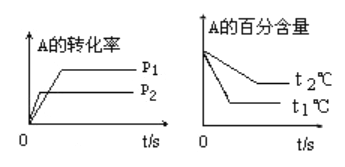
(1)压强p1比p2_____________(填“大”或“小”);(a+b)比(c+d)_____________(填“大”或“小”);温度t1比t2℃ _________(填“高”或“低”);正反应为______________热反应.
(2)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式____________________________。
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2固体和H2O(l)。已知室温下2 g SiH4自燃放出热量89.2 kJ,该反应的热化学方程式为_________________________。
(4)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H4的反应焓变为_____________(用含△H1、△H2、△H3的式子表示)。
【答案】小 小 高 吸热 2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=3116.6kJ·mol-1 SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)ΔH=-1427.2kJ·mol-1 2△H1+3△H2—2△H3
【解析】
根据压强、温度对化学反应速率和化学平衡的影响,分析气体分子数的变化及反应的热效应;进行简单计算,书写热化学方程式;依据盖斯定律,求“新”反应的反应热。
(1)据题图,p1条件下反应比p2条件下达到化学平衡用的时间长,则反应较慢,压强较小(p1<p2);p1条件下化学平衡时A的转化率较大,即减压使平衡右移,则(a+b)<(c+d)。同理,t1>t2,正反应吸热。
(2)在298K时,2mol C2H6 完全燃烧放热3116.6kJ。则热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=3116.6kJ·mol-1 。
(3)由2 g SiH4自燃放热89.2 kJ,可求得1molSiH4自燃放热1427.2kJ。则热化学方程式为:
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1427.2kJ·mol-1 。
(4)将已知和所求热化学方程式编号为:
①N2(g)+O2(g)=2NO(g) △H1
②2H2(g)+O2(g)=2H2O(g) △H2
③N2(g)+3H2(g)=2NH3(g) △H3
④4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H4
据盖斯定律,有④=①×2+②×3-③×2,则△H4=2△H1+3△H2—2△H3。


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近有科学家研发了一种新型锂空气电池,结构如下图所示。已知:①电解质由离子液体(离子能够自由移动,非溶液)和二甲基亚砜[(CH3)2SO]混合制成,可促进过氧化锂生成;②碳酸锂薄层的作用是让锂离子进入电解质,并阻止其它化合物进入该电极;③二硫化钼起催化作用。该装置工作时,下列叙述不正确的是

A. 放电时,a极发生氧化反应
B. 放电时的总反应为:2Li+O2=Li2O2
C. 充电时,Li+在电解质中由b极移向a极
D. 充电时,b极的反应式:Li2O2+2e-=2Li+O22-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水只作为还原剂的是( )
A.3Fe+4H2O(g)![]() Fe3O4+4H2B.2H2O
Fe3O4+4H2B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2Na2O2+2H2O═4NaOH+O2↑D.2F2+2H2O═4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,下列实验用如图所示装置不能完成的是 ( )
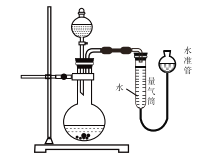
A. 测定一定质量的![]() 和
和![]() 混合物中
混合物中![]() 的含量
的含量
B. 确定分子式为![]() 的有机物分子中含活泼氢原子的个数
的有机物分子中含活泼氢原子的个数
C. 测定一定质量的![]() 晶体中结晶水数目
晶体中结晶水数目
D. 比较Fe3+和Cu2+对一定质量的双氧水分解反应的催化效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是__________。
A.c(HA)<c(A-)
B.c(HA)一定大于0.1 mol·L-1
C.c(Na+)=c(HA)+c(A-)
D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。
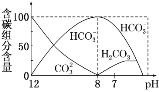
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是___________。
③已知在25 ℃时,CO32-水解反应的平衡常数Kh=2×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表、元素周期律及其相关应用叙述正确的是( )
A.原子的种类和元素的种类一样多
B.在现行元素周期表中,所含元素种数最多的是ⅢB族
C.可以在元素周期表金属与非金属分界处寻找催化剂
D.IA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜, 主要作用是在反应过程中只让Li+通过。结构如图所示。
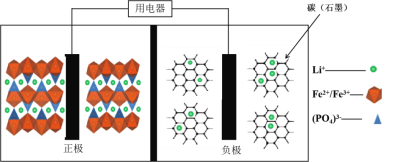
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A. 放电时,正极电极反应式:xFePO4+xLi++xe-===xLiFePO4
B. 放电时,电子由负极经导线、用电器、导线到正极
C. 充电时,阴极电极反应式:xLi++xe-+nC===LixCn
D. 充电时,Li+向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火法炼铜的原理为Cu2S+O2![]() 2Cu+SO2,下列说法中正确的是
2Cu+SO2,下列说法中正确的是
A.Cu2S只作还原剂
B.S元素发生还原反应
C.该反应既是氧化还原反应又是置换反应
D.当1 mol O2参加反应时,共转移4 mol e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com