
| 消耗量 |
| 起始量 |
| 0.6mol |
| 1mol |
| 0.6mol |
| 2L |
| 0.3mol |
| 2L |
| 1mol-0.6mol |
| 2L |
| c2(NO)c(O2) |
| c2(NO2) |
| 0.32×0.15 |
| 0.22 |


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、实验剩余的任何药品不能放回原试剂瓶 |
| B、用规格为10mL的量筒量取6mL的液体 |
| C、使用胶头滴管时,应使滴管始终垂直向下,一般不得伸入容器内 |
| D、粗盐提纯操作的顺序是:溶解、过滤、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
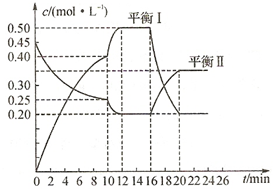 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
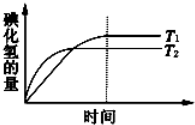 在密闭的容器中进行如下反应:H2(g)+I2(g)?2HI(g).在温度T1和T2时,产物的量与时间的关系如图所示,符合图象的正确判断是
在密闭的容器中进行如下反应:H2(g)+I2(g)?2HI(g).在温度T1和T2时,产物的量与时间的关系如图所示,符合图象的正确判断是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8mol |
| B、0.6mol |
| C、0.11mol |
| D、无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com