
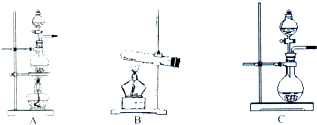
 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | C |
| ② | 制氨气 | NH4Cl→NH3 | B |
| ③ | 制氯气 | HCl→Cl2 | A或C |
分析 (1)反应①③为氧化还原反应,有电子的转移,反应②为非氧化还原反应,无电子的转移,实验室用氯化铵和熟石灰制备;
(2)根据反应物的状态和反应条件确定反应装置;
(3)实验室用H2O2制备氧气,为固体和液体在不加热条件下反应;
(4)根据氨气和二氧化碳在水中的溶解度判断,胶体具有丁达尔效应;
(5)①根据溶液稀释前后溶质的物质的量不变进行计算;
②根据用液体物质配制一定质量分数的溶液步骤有:计算、量取、稀释分析解答;
③容量瓶不能用待配溶液润洗;不能在容量瓶中稀释溶液.
解答 解:(1)反应③氯元素化合价升高,必须加入氧化剂才能实现;反应①③为氧化还原反应,有电子的转移,反应②为非氧化还原反应,无电子的转移,实验室用氯化铵和熟石灰制备,反应的方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:NH3;Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)反应①为液体不加热制取气体的装置,故选C;反应②为固固加热制取气体的装置,故选B;反应③为固液加热或不加热制取气体,故选A或C,
故答案为:
| 编号 | 发生装置 |
| ① | C |
| ② | B |
| ③ | A或C |
点评 本题考查制备方案的设计,题目难度中等,涉及物质的制备、实验装置的选用、溶液的配制等知识,明确常见物质性质及制备方法为解答关键,注意掌握配制一定浓度的溶液方法,(4)为易错点,可类比侯氏制碱法分析,试题培养了学生的分析、理解能力及化学实验能力.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 摩尔质量为126 | |
| B. | 式量为126 | |
| C. | 每个C3H6N6分子含3个N2分子 | |
| D. | 0.1NA个C3H6N6分子含碳原子数为1.806×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③②① | C. | ②①③ | D. | ②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 molCH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 向HCOOK和KOH的混合溶液中加入KMnO42KMnO4+HCOOK+KOH═2K2MnO4+CO2↑+H2O | |
| D. | 在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ②③ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com